Сотни видов цихлид обитают в Великих Африканских озерах. Эти разноцветные рыбки, как известно, характеризуются своим экологическим разнообразием. Цихлиды имеют 7 уникальных генов конопсина или колбочкового опсина, благодаря которым продуцируется пигменты, чувствительные к цветовому спектру от ультрафиолетового до красного. Как правило, у видов представлено лишь три зрительных пигмента, что определяет трихроматическое зрение. Так как виды обладают различными генами опсина, их цветовое восприятие может отличаться. В дополнение к большому количеству зрительных пигментов, набор которых зависит от экспрессии определенных генов, пигменты у цихлид очень тонко настраиваются вследствие перестроек в аминокислотной последовательности опсина. Два механизма настройки цветовосприятия играют большую роль в экологии цихлид и могут иметь эволюционное значение в видообразовании.
Цихлиды Великих Африканских озер знамениты своим разнообразием. Виды различаются по окраске, питанию и заботе о потомстве (Ribbink et al.1983, 1989; Keenleyside 1991; Seehausen 1996; Kon- ings 2001). Это разнообразие, наряду с совокупностью рыбок коралловых рифов, исключает образование цихлид от единой тесно связанной группы в период 10 млн.лет назад.
Дивергенция цихлид, вероятно, проходила за счет естественного и полового отбора (Dominey 1984; Kocher 2004; Albertson et al. 2005; Seehausen 2006). Естественный отбор вводил в эволюцию всевозможные кормодобывающие способы, включая хищничество, соскабливающий способ питания, питание моллюсками, водорослями, беспозвоночными и зоопланктоном, просеивание песка (Fryer & Iles 1972; Ribbink et al. 1983; Liem 1991; Yamaoka 1991; Konings 1995). Такая высокая специализация требовала особого развития сенсорных систем.
Половой отбор вводил в эволюцию разнообразие окраски, основанное на бесчисленных моделях полос и оттенков. Самцы цихлид часто более ярко окрашены, чем самки, и половой диморфизм строго коррелирует с половой системой (Seehausen et al. 1999). У диморфичных видов, яркие, заметные самцы обычно проявляют себя в местах совместных брачных демонстраций. Самки выбирают самцов, откладывают икринки, а затем берут их в рот на 3 недели. Самцы оплодотворяют икру, и, таким образом, лишь вносят генетическое разнообразие в следующее поколение. Данное посредственное участие сильно влияет на характер демонстраций самцов, включая ярко окрашенных особей или самцов, которые привлекают внимание постройкой жилища. Цветовая коммуникация свидетельствует о том, что зрение играет ключевую роль в социальном взаимодействии цихлид.
Обширные группы близких видов цихлид обитают в трех отдельных Великих Африканских озерах: Танганьика, Малави и Виктория. История становления и разнообразие видов этих озер отличается. Танганьика является наиболее старым озером (8-10 млн.лет) с 200-250 видами (Poll 1986; Konings 1998; Salz-burger et al. 2002; Clabaut et al. 2007). Малави моложе (1-2 млн.лет), но включает 500-1000 видов (Ribbink et al. 1983; Konings 1995; Turner et al. 2001; Genner et al. 2007). Виктория представляет собой наиболее молодое озеро (<12000 лет), однако уже насчитывает 400-500 видов (Johnson et al. 1996; Seehausen 1996). Быстрая эволюция многих видов за последнее время делает цихлид позвоночными с самым активным видообразованием.
Африканские озера отличаются по световому режиму. Танганьика и Малави представляют собой глубокие озера в местах разломов (глубина свыше 700 метров) и они до сих пор остаются очень чистыми. Так, озеро Малави описывается как второй самый чистый водоем в мире (Muntz 1976). Озеро Виктория несколько отличается, его глубина в основном не превышает 100 метров. Вследствие этого вода выглядит мутной и кровавой, что также является результатом деятельности человека и сопутствующей эвтрофикации (Seehausen et al. 1997). Особенности водной среды, вероятно, влияют на эволюцию эндемичных групп каждого озера.
Яркая окраска цихлид играет важную роль в спаривании. Лабораторные исследования показали, что визуальные сигналы самцов очень важны для выбора самкой коспецифичного, но не гетероспецифичного партнера (Seehausen & van Alphen 1998; Couldridge & Alexander 2002; Kidd et al. 2006). Визуальные сигналы также влияют на степень агрессии самцов по отношению друг к другу (Dijkstra et al. 2005), что определяет сосуществование видов (Seehausen & Schluter 2004). Так как тесно связанные виды цихлид отличаются лишь окраской самцов, а не морфологией или поведением (McElroy & Kornfield 1990), визуальные сигналы становятся ключевыми в идентификации вида и выборе полового партнера (Albertson et al. 1999; Danley & Kocher 2001; Streelman & Danley 2003).
Фоторецепторы и зрительные пигменты
Сетчатка позвоночных содержит два вида фоторецепторов: палочки и колбочки (Walls 1942). Фоторецепторы включают зрительные пигменты, которые, будучи освещенными, продуцируют каскад сигналов, переходящих в нервный импульс. Зрительные пигменты характеризуются длиной волны, которую они принимают от смешанного света (Dartnall 1953; Govardovskii et al. 2000). При рассмотрении цветового зрения особое внимание следует уделять колбочкам. Используя микроспектрофотометрию, ученые установили, что у рыбок может проявляться 4 различных типа зрительных пигментов колбочек, каждая из которых принимает определенный участок спектра (Loew & Lythgoe 1978; Bowmaker 1995).
Рыбьи колбочки имеют либо одиночное, либо парное строение (Walls 1942; Bowmaker 1995). Одиночные колбочки меньше и содержат зрительные пигменты, улавливающие короткие волны. Парные образования представляют собой две слившиеся вместе колбочки. Они, в свою очередь, возбуждаются под действием длинноволнового спектра, и могут содержать одинаковые, либо разные типы пигментов (Loew & Lythgoe 1978; Levine et al. 1979).
Первой цихлидой, зрительная система которой изучалась при помощи микроспектрофотометрии, являлась Astatotilapia burtoni, обитающая в болотах и реках близ озера Танганьика. Представители данного вида имеют одиночные и двойные колбочки и три зрительных пигмента с пиком поглощения 455, 523 и 562 нм (Fernald & Liebman 1980). Данные пигменты подобны пигментам других пресноводных рыб (Loew & Lythgoe 1978; Levine & MacNichol 1979), а также с очень схожи с синим, зеленым и красным пигментами человека, пик поглощения которых составляет 420, 534 и 563 нм, соответственно (Bowmaker & Dartnall 1980). Последующие исследования викторианских цихлид показали, что они имеют подобные синие, зеленые и красные колбочки (таблица 1, van der Meer & Bowmaker 1995; Carleton et al. 2005).
Тем не менее, малавийские цихлиды обладают гораздо большим разнообразием зрительных пигментов (таблица 1, Carleton et al. 2000; Parry et al. 2005; Jordan et al. 2006). Насчитывается, по меньшей мере, 6 различных пигментов, которые составлены в трех комбинациях (рисунок 1). Некоторые виды имеют одиночные колбочки, воспринимающие ультрафиолетовый свет длиной 400 нм, а также парные колбочки, поглощающие среднюю область спектра – 488 и 535 нм. Другие виды имеют чувствительные к фиолетовому излучению одиночные колбочки и вместе с тем обладают средневолновыми парными колбочками. Последняя комбинация, обнаруженная у вида A. burtoni или викторианских цихлид, представляет собой синие одиночные колбочки с чувствительными для длинных волн двойными колбочками. Разнообразие зрительных пигментов в озере Малави, является беспрецедентным явлением для таких родственных видов, развивающихся в течение 1-2 млн.лет.
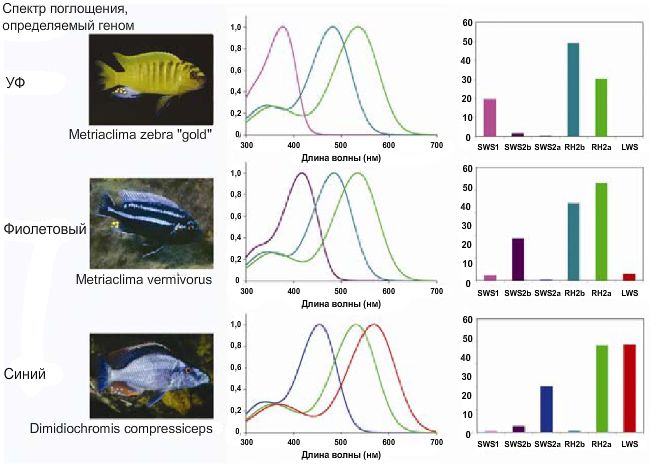
Рисунок 1.
Разнообразие зрительных пигментов, обнаруженных у цихлид. Воссозданная модель спектра поглощения зрительных пигментов иллюстрирует (в центре) три основных комбинации зрительных пигментов. Кривые высчитывались с использованием
A1 шаблонов по Govardovskii et al.(2000), онованные на λmax, которая измерялась с помощью микроспектрофотометрии.
Хотя большинство исследуемых образцов обладают тремя зрительными пигментами, детальное изучение нескольких видов при помощи микроспектрофотометрии свидетельствует о том, что цихлиды могут иметь другие дополнительные колбочковые пигменты (таблица 1). Число подобных необычных образований невелико (<10%), но является статистически значимым. Они продуцируют пигменты, отличающиеся от трех основных типов, обнаруженных у рыбок. В тоже время, спектрально эти пигменты коррелируют с основными типами пигментов, наблюдаемых у других цихлид. Неизвестно, играют ли они роль в формировании визуальной чувствительности.
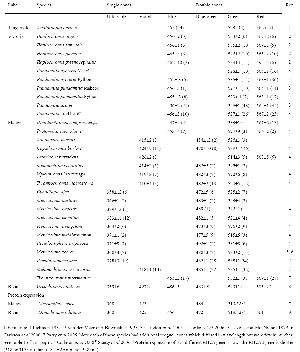
Таблица 1. Пик поглощения зрительных пигментов африканских цихлид, определенных с помощью микроспектрофотометрии или экспрессии белка. Пигменты разделены на спектральные группы, базирующиеся на значениях λmax. (1 Fernald and Liebman 1981. 2 van der Meer and Bowmaker 1995. 3 Carleton et al 2005. 4 Jordan et al 2006. 5 Levine and MacNichol 1979. 6 Carleton et al 2000. 7 Parry et al 2005. У каждого вида отмечаются дополнительные «бродячие» колбочки, которые отличаются по длине воспринимаемой волны, но их количество невелико.8 Carleton et al 2008 9 Spady et al 2006. †Экспрессия белков двух различных генов RH2A для показывает, что RH2Aβ (518 or 519 нм) короче, чем ген RH2Aα (528 nm).)
Хромофоры ретиналя
Зрительные пигменты состоят из белка опсина и хромофора ретиналя (Dowling & Wald 1960). У рыбок хромофор представляет собой 11-цис ретиналь, полученный от витамина A1, либо 3,4-дидегидроретиналя, который, в свою очередь, продуцируется из витамина A2 (Beatty 1984; Bowmaker 1995). Хромофоры способны переходить друг в друга в течение нескольких недель. Трансформация формы A1 в A2 подстраивает зрительный пигмент на поглощение более длинных волн. Данное изменение пропорционально спектральному ряду, когда коротковолновые пигменты подстраиваются только в диапазоне 10 нм, а длинноволновые — 60 нм (Harosi 1994; Parry & Bowmaker 2000). Хромофоры различных видов цихлид были грубо идентифицированы при помощи микроспектрофотометрии. Обнаружено, что пик поглащения A1 пигмента тоньше, чем A2. Ранние исследования говорят о том, что малавийские цихлиды преимущественно используют A1 хромофоры (Muntz 1976; Carleton et al. 2000; Parry et al. 2005; Jordan et al. 2006). Однако микроспектрофотометрия викторианских цихлид и рядом расположенных речных теляпий свидетельствует, что цихлиды используют A1/ A2 смесь (Carleton et al. 2005, 2008). Трансформация хромофора может быть ещё одним механизмом, за счет которого цихлиды подстраивают чувствительность своей зрительной системы в коротких временных промежутках. Так как африканские озера находятся на большом удалении, до настоящего времени не проведена идентификация хромофоров диких особей.
Гены конопсина
Подстройка зрительных пигментов может производиться как за счет взаимодействия смеси хромофоров, а также за счет изменения последовательности белка опсина. Гены позвоночных, кодирующие опсин, делятся на 5 классов: родопсин и 4 класса конопсина (Yokoyama 2000). Гены конопсина классифицируются благодаря их спектральной чувствительности: чувствительны для очень коротких волн (short wavelength sensitive — SWS1), чувствительны для коротких волн (short wavelength sensitive – SWS2), чувствительны для средней длины и общих с родопсином волн (RH2) и чувствительны для длинных волн (long wavelength sensitive — LWS). Озвученные классы опсина возникли в начале эволюции позвоночных, 500 млн.лет назад (500 Ma — megaannum) (Collin et al. 2003). Изменения аминокислотной последовательности, направленные на ретиналь-связывающие области, смещает спектр поглощения зрительных пигментов так, что каждый класс, в конечном счете, настроен с единичными аминокислотными заменами (Kochendoerfer et al. 1999; Yokoyama 2000; Hunt et al. 2007).
Для определения молекулярных оснований разнообразия зрительных пигментов цихлид секвенированы гены конопсина. Используя дегенерированные праймеры, а затем быструю амплификацию с концами кДНК, были идентифицированы 5 генов конопсина (Carleton et al. 2000; Carleton & Kocher 2001). Их назвали SWS1, SWS2b, SWS2a, RH2 и LWS. Позднее исследователи установили, что имеются дополнительные дупликации в RH2 гене, приводящие к трем спектрально специфическим опсинам. Данные дупликации получили название RH2b, RH2aβ, and RH2aα (Parry et al. 2005). Изначально опубликованные последовательности гена RH2 соответствуют RH2aβ. Схожесть данных генов является следующей: RH2b и любой из RH2a генов в меньшей степени (80%) похожи друг на друга, чем RH2aα и RH2aβ между собой (90%). Обнаружение 7 генов опсина стало неожиданностью, потому что зрительная система цихлид включает лишь три зрительных пигмента. Тем не менее, последние работы говорят о том, что дупликации генов опсина являются общими для рыбок (Chinen et al. 2003; Matsumoto et al. 2006; Ward et al. 2008).
Спектральная чувствительность генов опсина
Для определения спектральной чувствительности ряда генов исследователи представили соответствующие белки с воссозданными пигментами, использующими 11-цис ретиналь (таблица 1). Было рассмотрено 5 генов конопсина цихлиды Metriaclima zebra (Parry et al. 2005) и все 7 генов теляпии Oreochromis niloticus (Spady et al. 2006). В результате пик поглощения данных пигментов покрыл спектр от УФ- излучения (SWS1) до длинных волн (LWS). Кроме того, пигменты формировали полную полосу поглощения. Значения λmax воссозданных пигментов отлично согласуются со зрительными пигментами, которые ранее определялись при помощи микроспектрофотометрии. В данном сравнении исследователи сгруппировали вместе два RH2A пигмента, потому что они сложно определялись при микроспектрофотометрии. Их спектр поглощения приходился на средние волны.
Сравнение λmax для представленных белков у речного O. Niloticus и озерной цихлиды M. Zebra показали небольшие спектральные различия (<10 нм для SWS1, SWS2b и RH2b) или вообще не показали различий (для RH2aα и β) между соответствующими белками. Так как изучались наиболее дивергентные цихлиды, как филогенетически (20 млн.лет), так и по ареалу обитания, можно ожидать, что их гены дивергировали. Так как большинство дивергентных генов определяли высокую схожесть поглощения зрительных пигментов, то маловероятно, что различия последовательностей могли вызвать значительные вариации (30-80 нм), наблюдаемые для зрительных пигментов малавийских цихлид.
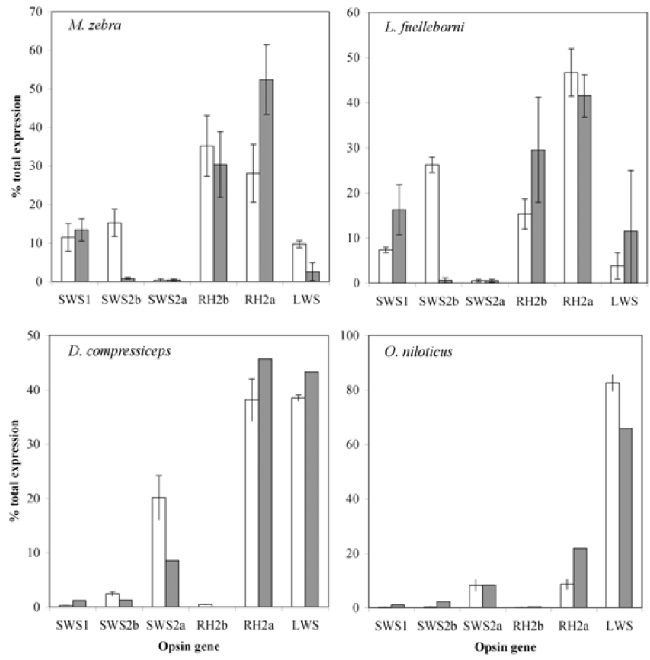
Рисунок 2.
Экспрессия генов для 4 видов цихлид. Белыми столбцами показаны правильная экспрессия генов, ранее рассмотренна Carleton и Kocher (2001). Серыми столбцами показаны экспрессия генов для диких особей, выловленных близ
Кейп Маклер (Таблица 2). Дикие особи Oreochromis являются Oreochromis sp, а не видом O. niloticus.
Различная экспрессия генов настраивает чувствительность зрительного пигмента
Для проверки того, может ли последовательность опсина включаться в создание разнообразия зрительных пигментов малавийских цихлид, исследователи сравнили последовательности гена конопсина между видами, обладающими пигментами с различным поглощением. Обнаружено, что данные виды имеют практически идентичные последовательности для каждого из соответствующих генов опсина. Это особенно заметно, когда рассматриваются ключевые аминокислоты в связывающей ретиналь области (Carleton & Kocher 2001). Более того, значительные различия визуальных пигментов малавийских цихлид не вызвано изменением последовательности опсина, потому что её вариации незначительны.
На самом деле, цихлиды озера Малави настраивают свои зрительные пигменты за счет изменений совокупности экспрессируемых генов опсина. Различная экспрессия генов была определена при проведении полимеразной цепной реакции в реальном времени или количественной ПЦР, которая определяет относительное количество генов конопсина, экспрессирующихся в сетчатке конкретных видов. ПЦР выполнялась для двух скальных видов цихлид (M. zebra и Labeotropheus fuelleborni), одного песчаного (Dimidiochromis compressiceps) и тиляпии, Oreochromis niloticus. Обнаружен значительные отличия в экспрессии генов между скальными и песчаными видами, которые, соответственно, обладают разной чувствительностью зрительных пигментов.
Мелкомасштабные вариации в экспрессии генов
Для того, чтобы обратиться к мелкомасштабным вариациям, исследователи сравнили результаты выращенных в лаборатории особей с дикими экземплярами, которые были выловлены в 2005 году около Кейп Маклер, Малави (таблица 2, O’Quin et al, неопубликованные данные). Так как в озере Малави не обитает O. Niloticus, изучались дикий тип Oreochromis, был определен как Oreochromis sp., и мог относиться к виду Oreochromis shiranus или Oreochromis squamipinnis. Сопоставление лабораторных и диких типов для D. compressiceps и Oreochromis продемонстрировали общий уровень экспрессии генов. Однако для скальных видов, M. zebra и L. fuelleborni, у диких особей наблюдалась экспрессия лишь трех генов, меньше, чем у лабораторных животных. Исследователи полагают, что данные различия экспрессии реальны и отражают имеющиеся популяционные отличия между лабораторными скальными видами и дикими особями. Родиной лабораторного вида M. Zebra являлся залив Нхата Бэй, который располагается на 270 км севернее Кейп Маклер, где собираются дикие особи. Кроме того, недавние работы свидетельствуют о том, что среди диких типов озера Малави (O’Quin et al., неопубликованные данные), а также между популяциями озера Виктория (Carleton et al. 2005, Hofmann et al., неопубликованные данные) имеются значительные вариации в числе экспрессируемых генов. Примером такого расхождения может служить сравнение M. zebra
«gold» (рисунок 1) и синие виды M. Zebra (рисунок 2). В данном случае, у M. zebra
«gold» экспрессируется лишь три гена, а у M. Zebra их больше. Экспрессия более чем трех генов согласуется с детальными микростереоскопическими исследованиями, в которых виды обладают дополнительными зрительными пигментами в небольшом количестве (Parry et al. 2005). Это также подтверждается при изучении электроретинограммы видов рода Metriaclima, которым требуется 4 зрительных пигмента для адекватной модели электроретинограммы (Garner et al. 2003; Olson et al. 2004). Экспрессия более чем 4 генов также отмечена на определенных стадиях развития тиляпии и подтвержается микростереоскопически (Carleton et al. 2008).
Различия лабораторных и диких особей также может быть вызвано уровнем освещения в течение выращивания. На самом деле, световой режим в лабораторных условиях был немного ниже, чем наблюдающийся в природе. Предварительные эксперименты для проверки эффектов светового режима свидетельствует о том, что выращивание цихлид в условиях низкой освещенности незначительно влияет на экспрессию генов. Цихлиды не проявляют одинаковой лабильности экспрессии, что, в частности, продемонстрировано на лукании Гуда (Lucania goodei) (Fuller et al. 2004, 2005). Однако полным ходом продолжаются исследования для детальной проверки эффектов светового режима.
Экспрессия дополнительных генов может являться результатом геномной организации генов опсина в близкорасположенных тандемных рядах. Для понимания пространственного распределения генов и рассмотрения возможности коэкспрессии требуются исследования, использующие микростереоскопию или in situ гибридизацию. Кроме того, для определения нейронального антагонизма и оценки вовлеченности дивергенции в генетическую экспрессию и, следовательно, в настройку чувствительности зрительного пигмента, необходимы поведенческие исследования, а также электрофизиология для оценки возможности действия вещества.
Модели экспрессии опсина на различных стадиях развития рыбок
Цихлиды озера Малави обладают чрезвычайным разнообразием зрительных пигментов, что является результатом экспрессии различных генов опсина. Возникает вопрос, как цихлиды поддерживают так много генов опсина, если они экспрессируют лишь немногие из них? Тиляпия и виды малавийских цихлид дивергировали 20 млн.лет. На данном временном промежутке гены, которые не экспрессировались, затухали и становились псевдогенами. Однако как O. niloticus, так и M. zebra обладают 7 генами конопсина. Они полностью функциональны, и в экспериментах in vitro создают функциональные пигменты (Parry et al. 2005; Spady et al. 2006).
Кроме секвенирования этих 7 генов O. niloticus, так и M. zebra, ученые секвенировали гены многих других африканских цихлид. Работа включала 11 видов из озера Малави (Spady et al. 2005), 10 видов из озера Виктория (Carleton et al. 2005; Hofmann et al. in prep) и 15 видов из озера Танганьика (O’Quin et al. in prep). Имелось 2 танганьикских вида с генами, которые имели приобретенные бессмысленные мутации, свидетельствующие о том, что псевдогены могут появляться (Spady et al. 2005).
Как правило, все 7 генов конопсина присутствуют и функционируют среди всего многообразия африканских цихлид. Более того, остается вопрос, почему сохраняются гены, не экспрессирующиеся у взрослых ?
Одним из возможных объяснений является то, что на различных этапах развития рыбка может предъявлять особые требования к чувствительности зрительного пигмента и, отсюда, наблюдается экспрессия различных генов конопсина. Количественная ПЦР оказывается идеальным методом рассмотрения экспрессии генов на различных стадиях развития. Исследователи изучили модели развития экспрессии опсина у теляпии O. niloticus. Данный вид является родственным таксоном для всех африканских цихлид. При взятии нескольких особей из единого выводка через каждые несколько дней, ученые картировали развитие опсина (Рисунок. 3a; Carleton et al. 2008). Были обнаружены значительные изменения экспрессии генов опсина во время постэмбрионального развития рыбки. В течение нескольких первых месяцев жизни рыбок, одиночные колбочки начинали экспрессировать SWS1, затем переходили к SWS2b, и, наконец, к SWS2a. Это означет, что одиночные колбочки переходили от поглощения УФ-излучения до восприятия синего. Двойные колбочки начинали экспрессировать RH2b, RH2a и LWS, однако во взрослом состоянии прекращали экспрессию RH2b и усиливали LWS. Эти изменения коррелировали с одиночными колбочками так, что происходило смещение спектральной чувствительности зрительной системы тиляпии от коротковолнового до длинноволнового излучения. Изменения заканчивались к 6 месяцам, когда теляпия достигала половой зрелости.
Далее исследователи сопоставили развитие тиляпии с малавийскими цихлидами (Рисунок. 3b, Carleton et al. 2008). Было обнаружено, что у видов, экспрессирующих гены к коротковолновому излучению, таких как M. zebra или L. fuelleborni, на ранних стадиях проходит экспрессия УФ-генов и затем она поддерживается. Наблюдается некоторое развитие
«фиолетовых» генов, однако оно прекращается. У данных видов, кроме того, развитие происходит медленнее, чем у тиляпии, от личиночной стадии («ультрафиолетовые») до малька («фиолетовые» гены) и никогда не наблюдается экспрессия взрослых «синих» генов. В противоположность этому, виды D. compressiceps или Tramitichromis intermedius, экспрессирующие «синие» гены, продолжают и поддерживают их развитие. Они, кроме того, перепрыгивают непосредственно до взрослого гена тиляпии, пропуская экспрессию других генов.
Таблица 2. Экспрессия генов 6 классов конопсина лабораторных (L) и диких (W) особей. Экспрессия представлена как
% от общего конопсина (†Corrected data from Carleton и Kocher (2001). ‡New data from O’Quin et al., неопуликованные данные. §Data from Carleton et al. (2008)).
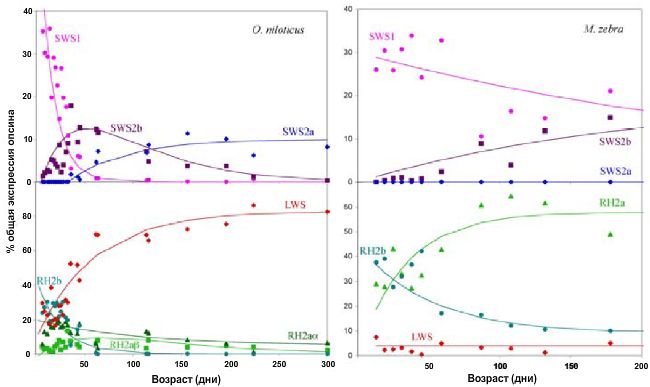
Рисунок 3. Прогрессия экспрессии опсинового гена в зависимости от стаии развития O. niloticus (a) и M. zebra (b). Верхняя панель показывает экспрессию генов в одиночных колбочках коротковолновой чувствительности (SWS1(О), SWS2b (квадрат) и SWS2a (♦). Нижняя панель показывает экспрессию генов в двойных колбочках длинноволновой чувствительности RH2b(О), RH2aα (треугольник), RH2aβ (квадрат) и LWS (♦).RH2a экспрессия для M. zebra является суммой RH2a α и β.
Наблюдалась схожая постоянная экспрессия «синих» генов у личинок и взрослых особей рода Pundamilia из озера Виктория, демонстрирующая непосредственную экспрессию взрослых генов (Carleton et al. 2005).
Сравнения всех этапов развития цихлид говорит о том, что изменения экспрессии генов у взрослых особей являются результатом времени и степени экспрессии опсина в постэмбриональном развитии. Данные гетерохронические изменения позволяют малавийским цихлидам преобретать различия чувствительности зрительных пигментов, либо оставляя личиночный или мальковый набор генов, либо перепрыгивая непосредственно к экспрессии генов взрослых. Хетерохрония, как известно, является ключевым механизмом во модификации организменной морфологии. Кроме того, показано, что она является ключевым процессом, воздействующим на дивергенцию и эволюцию сенсорной системы.
Хотя гетерохрония опсиновых генов до сих пор не исследована у других рыб, имеются сведения о нескольких видах с множественными опсиновыми генами, включая луканию Гуда (Fuller et al. 2003; Fuller et al. 2004), данио рерио (Chinen et al. 2003), медака (Matsumoto et al. 2006) и гуппи (Hofmann et al. 2007; Weadick & Chang 2007; Ward et al. 2008). Эти множественные гены обеспечивают необходимый субстрат для эволюции дифференциальной экспрессии, которая может изменять зрительную чувствительность. Исследования зрительных пигментов родственных видов демонстрируют разнообразие пигментов с различиями между видами. Данные работы включают микростереоскопическое изучение рыб коралловых рифов (Losey et al. 2003) и люцианов (Lythgoe et al. 1994). Дифференциальная экспрессия опсина и гетерохрония могли играть роль в смещении визуальной чувствительности у данных видов.
Настройка оспиновой последовательности и видообразование
Цихлиды настраивают зрительные пигменты за счет изменения экспрессии генов в сетчатке. Они также могут более точно подстраивать чувствительность через изменение последовательность опсинового гена. Это четко прослеживается на примере викторианских видов. LWS опсиновая последовательность очень вариабельна среди викторианских цихлид и является одним из наиболее вариабельных генов, известных для данных видов (Terai et al. 2002). Изменения последовательности LWS вероятно приводит к позитивной селекции, когда виды адаптируются к метам обитания (Terai et al. 2006) или глубинам (Seehausen et al. 2008). Небольшие изменения последовательности LWS в ключевых областях вызывает смещение зрительного пигмента, который влияет на половое предпочтение. В нескольких парных сравнениях, красные виды демонстрировали немного более длинноволновую чувствительность пигмента LWS, чем синие виды (Carleton et al. 2005; Terai et al. 2006; Seehausen et al. 2008). Это коррелировало с красными видами, обитающими в глубоких водах, где красная окраска может лучше освещаться и обеспечивать более выразительные сигналы, чем от коротковолнового синего цвета. Это также согласуется с данными оптомоторных экспериментов, в которых красные виды являлись более чувствительными к красному свету, а синие виды к синему (Maan et al. 2006). Кроме того, адаптация зрительной чувствительности в соответствии со спектральными характеристиками поверхностных или глубоких вод может привести к изменению половой окраски цихлид. Этот процесс может явиться сенсорным пусковым механизмом и вызвать толчок для видообразования цихлид (Seehausen et al. 2008).
Заключение
Зрительная система цихлид отличается наибольшим разнообразием чувствительности, известной для позвоночных. Данные различия являются результатом мелкомасштабной настройки через изменение аминокислотной опсиновой последовательности и крупномасштабной – через смену экспрессии генов опсина. Мелкомасштабная настройка связана с особенностями светового режима и окраски цихлид, и, вероятно, имеет пусковое значение для видообразования викторианских цихлид. Изменения экспрессии генов происходят в зависимости от модификаций опсина в постэмбриональный период развития. Экспрессия определяется либо сниженным темпом жизни, наблюдающегося у личинок и мальков, либо ускоренным темпом, который характеризуется непосредственной экспрессией взрослых генов.
——
Carleton Karen. Cichlid fish visual systems: mechanisms of spectral tuning // Integrative Zoology 2009; 4: 75-86
Для ознакомления рекомендуется скачать оригинал статьи, который представлен в открытом доступе по адресу: cichlid.umd.edu/cichlidlabs/kc/pdfs/Carleton2009.pdf

статья классная, но требует значительных знаний в области генетики ) терминология давит))