Все виды гурами принадлежат подотряду Anabantoidei и известны под общим названием – лабиринтовые рыбы. Данное обозначение связано, в первую очередь, с наличием дополнительного органа дыхания – лабиринтового аппарата. Он располагается в наджаберной полости и образован складками мембран, покрывающими костяной остов. Тонкая ткань пронизана сетью кровеносных капилляров и по выполняемым функциям напоминает легкие наземных животных. Если не допускать лабиринтовых рыбок к атмосферному воздуху, они задохнутся, потому что жабры не обеспечивают в полной мере запросы организма.
Существует свыше сотни Anabantoidei, которые продаются в качестве декоративных рыбок. Многие виды внутри различных родов характеризуются наличием нескольких цветовых вариаций. В частности, среди них можно выделить представителей рода Betta, около 20 видов рода Ctenopoma, несколько видов рода Colisa, Macropodus, Anabas, Helostomidae, Pseudomodas, Sandelia и многочисленные виды Trichogaster.
Род Trichogaster включает большинство популярных аквариумных гурами, например, жемчужного, лунного гурами, гурами бурого «змеиная кожа», трехточечного, голубого, серебряного, золотого, опаловый гурами, а также гибриды того же рода. Все эти рыбки размножаются схожим образом, поэтому описанные процедуры могут быть использованы для многих других родов гурами.
Таксономический статус
Существует 16 родов и 50 видов подсемейства Trichogasterinae, распространенных по всей Азии, Индийскому субконтиненту и Центральной Африке (Degani et al., 1992 и Alfred, 1962). Как и в случае со многими описаниями семейств рыб, номенклатура родов и видов гурами претерпела много изменений и реклассификации. Trichogaster Trichopterus, «трехточечный», пятнистый или обыкновенный (далее просто гурами) изначально был известен как Labrus trichopterus, а в 1801 году его переименовали в Trichogaster Trichopterus (Richter 1988). В литературе могут встретиться и другие название данного вида, например, Trichopus trichopterus, Trichopus sepat, Osphromemus siamensis, Osphromenus trichopterus, Trichopus siamensis, Trichopodus maculatus и Osphromenus saigonensis. Большинство из них появилось при переделке номенклатуры в середине 1800-х годов до момента, когда окончательно не утвердилось название Trichogaster Trichopterus. В таблице 1 представлена современная классификация лабиринтовых рыб (Anabantoidei) (Richter, 1988).
|
Отряд |
Perciformes |
|
Подотряд |
Anabantoidei |
|
Семейство |
Belontiidae |
|
Подсемейство |
Belontiinae |
|
Род |
Belontia |
|
Подсемейство |
Trichogasterinae |
|
Род |
Trichogaster, Colisa |
|
Подсемейство |
Ctenopinae |
|
Род |
Pseudosphromenus, Parosphromenus, Malpulutta, Trichopsis, Ctenops, Betta |
|
Подсемейство |
Macropodinae |
|
Род |
Macropodus |
|
Подсемейство |
Spaerichthyinae |
|
Род |
Parasphaerichthys, Sphaerichthys |
|
Семейство |
Helostomidae |
|
Род |
Helostoma |
|
Семейство |
Osphronemidae |
|
Род |
Osphronemus |
|
Семейство |
Anabantidae |
|
Род |
Anabas, Sandelia, Ctenopoma, Oshimia |
Таблица 1. Классификация по Richter, 1988.
Распространение
 Лабиринтовые рыбы обнаруживаются в Южной и Западной Африке, а также Восточной и Юго-восточной Азии. На иллюстрации 1 представлен ареал обитания рыб данного подотряда. Естественная среда обитания лабиринтовых тянется от северной границы Китая на широте 50 градусов. Восточная граница находится в Корее на широте 130 градусов. Наиболее южная полоса распространения семейства отмечена на Суматре, южнее экватора, которая на западе обрывается Индией на широте 70 градусов. Trichogaster Trichopterus обитает на юге Вьетнама, островах Сунда, в Таиланде, Малайском полуострове (Richter, 1988).
Лабиринтовые рыбы обнаруживаются в Южной и Западной Африке, а также Восточной и Юго-восточной Азии. На иллюстрации 1 представлен ареал обитания рыб данного подотряда. Естественная среда обитания лабиринтовых тянется от северной границы Китая на широте 50 градусов. Восточная граница находится в Корее на широте 130 градусов. Наиболее южная полоса распространения семейства отмечена на Суматре, южнее экватора, которая на западе обрывается Индией на широте 70 градусов. Trichogaster Trichopterus обитает на юге Вьетнама, островах Сунда, в Таиланде, Малайском полуострове (Richter, 1988).
Особи Trichogaster trichopterus предпочитают рисовые поля Африки и Азии, где они часто собирались для питания (Alfred, 1962). Кроме рисовых полей представители данного вида населяют заросли вдоль рек, каналов, озера, канавы и топи, избегая, тем самым, хищных рыб и птиц.
Морфология
Большинство лабиринтовых рыб имеют общее строение плавников. Половой диморфизм у них определяется различиями в форме и/или окраске плавников и тела. Виды рода Trichogaster являются прекрасным примером, самцы и самки которых демонстрируют различия строения плавников. Спинной плавник самца длиннее, чем у самки и достигает основания хвостового. У карликовых гурами наблюдается цветовой диморфизм. Самцы ярче окрашены, у них также имеется большее разнообразие цветовых комбинаций, в то время как у самок лишь серые темно-серебристые тона. У вида Betta splendens самцы имеют гораздо более длинные плавники по сравнению с самками, кроме того, они ярче окрашены.
Определение пола
Надежным методом определения половой принадлежности особей рода Trichogaster является выращивание молоди с ранних лет и диагностика размера их спинного плавника. У самцов он длинный, обычно, когда опущен и лежит на спине, достигает основания хвостового плавника. У самок спинной плавник всегда короткий. Кроме того, половозрелые самки мельче самцов и имеют более округлое брюшко.

Размножение
Мраморный гурами достигают 15-20 см в длину (Axelrod et al. 1993), а при 7 см они могут размножаться (12-14 неделя) (McKinnon et al. 1987). У лабиринтовых имеется три основные типа икринок: плавающие на поверхности (плодовитость 800-20000 икринок), донные (100-300) и вынашиваемые во рту (40-800).
Особи, использующие для инкубации пенное гнездо, строят его на поверхности воды или под водой. Пена состоит из пузырьков, включающих примесь слизи, выделяемой самцом. Гнездо, которое построено на поверхности, обычно располагается среди надводных растений. В качестве субстрата для гнезда, помимо растений может выступать любой твердый субстрат, камни и дерево. В зависимости от вида лабиринтовых рыб, они используют пригодный для нереста субстрат, либо готовят место для гнезда сами. Виды, не заботящиеся о потомстве, не строят гнездо, а просто мечут икру в толще воды. Также не возводят пенное гнездо особи, инкубирующие икру во рту. У данных рыбок самец ловит икринки анальным плавником, которые затем собирает самка и помещает их на инкубацию в рот самцу. Другие виды лабиринтовых позволяют икринкам упасть на дно и только потом собирают их в рот. Поверхностные икринки имеют жировые включения, поэтому они легче воды и после икрометания всплывают на поверхность. Развивающиеся личинки также имеют в составе желточного мешка жировые включения, обеспечивающие плавучесть. Как правило, поверхностные икринки очень маленькие, и развивающиеся из них личинки имеют небольшое количество желтка. Они получают мало заботы со стороны родителей и требуют изобилие корма уже на ранних этапах жизненного цикла. Лабиринтовые рыбы, имеющие поверхностную икру, обычно строят пенное гнездо, либо являются свободномечущими. Донные икринки не имеют жировых включений, они тяжелее воды и сразу после нереста оседают на дно. Как правило, данная икра крупная, имеет много желтка в своем составе. Полученные из неё личинки не нуждаются в корме на начальной стадии развития и после перехода к свободному плаванию сразу питаются относительно крупными пищевыми частицами. Лабиринтовые, имеющие крупную икру, часто инкубируют её во рту, либо строят пенное гнездо (Scheurmann 1989).
Оогенез у мраморного гурами представлен несколькими стадиями: 1. Стадия нуклеолярного (ядрышкового) хроматина; 2. перинуклеарная стадия; 3. Стадия нуклеарного (ядерного) хроматина; 4. Вителлогенез; 5. Дробление бластулы; 6. Стадия зрелого яйца (Degani 1992). Во время цикла размножения первые 4 стадии отмечаются в яичниках в различных соотношениях. Самка с низким процентом яиц, находящихся на стадии вителлогенеза, не готова к размножению. За счет строительства гнезда и ухаживаний самец стимулирует самку к переходу на этап вителлогенеза, после которого следует дробление бластулы. Непосредственным стимулятором созревания самки являются стероидные глюкурониды, находящиеся в воде около гнезда (Degani 1992).
|
Тип гнезда |
Тип икры |
Вид |
|
Пенное |
Поверхностная |
Colisa sota |
|
|
|
Colisa fasciata |
|
|
|
Colisa labiosa |
|
|
|
Colisa lalia |
|
|
|
Macropodus chinensis |
|
|
|
Macropodus concolor |
|
|
|
Macropodus opercularis |
|
|
|
Trichogaster leeri |
|
|
|
Trichogaster microlepis |
|
|
|
Trichogaster trichopterus |
|
|
|
Ctenopoma ansorgii |
|
|
|
Ctenopoma nanum |
|
Пенное |
Донная |
Betta imbellis |
|
|
|
Betta splendens |
|
Инкубация во рту |
Донная |
Betta picta |
|
|
|
Betta pugnax |
|
|
|
Betta taeniata |
|
Свободно мечут |
Поверхностная |
Helostoma temmincki |
|
|
|
Ctenopoma kingsleyae |
|
|
|
Ctenopoma maculatum |
|
|
|
Ctenopoma muriei |
|
|
|
Ctenopoma oxyrhynchus |
Таблица 2. Особенности инкубации и типы икринок.
У различных видов лабиринтовых существуют поведенческие особенности, которые отражают тип заботы о потомстве. Чаще всего встречаются пять типов поведения.
|
Тип родительской заботы |
Подсемейство и род |
|
Самец ухаживает за большим количеством поверхностных икринок |
Trichogasterinae, Anabantinae (представители, строящие пенное гнездо), Ctenopoma и Osphronemidae |
|
Самец ухаживает за небольшим количеством донных икринок |
Ctenopinae, за исключением некоторых представителей Betta, инкубирующих во рту |
|
Самец вместе с самкой ухаживают за большим количеством поверхностных икринок |
Macropodinae |
|
Самка ухаживает за небольшим количеством донных икринок; инкубация во рту |
Sphaerichthyinae |
|
Нет родительской заботы за большим количеством поверхностных икринок |
Helostomidae, Anabantinae, Anabas |
Таблица 3. Тип родительской заботы.
Большинство представителей, которые мечут поверхностную икру, являются популярными декоративными видами, активно разводящихся на продажу. Преимуществом их коммерческого разведения является высокая плодовитость, легкость подготовки производителей к нересту и дальнейшее выращивание мальков. Некоторые мелкие виды, например, карликовый гурами, нуждается для нереста в 4 литровом аквариуме. Хотя цена на молодь гурами довольно низкая, они разводятся в огромных количествах. Пожалуй, исключением из данного правила выступает макропод. Они продуцируют небольшое количество икринок и их разведение затруднительно.
С коммерческой точки зрения среди представителей, икра которых тонет, в первую очередь, следует обратить внимание на род Betta. С самого своего появления в аквариумах любителей, они пользуются высокой популярностью. В частности, на период 1992 года (Chapman et al., 1994) особи Betta splendens занимали 4 место по объемам и цене продаж среди импортируемых видов. Различные виды Betta активно разводятся на рыборазводческих фермах. Тем не менее, вследствие высокой агрессивности самцов друг другу, самок, а также малой плодовитости, их массовое производство затруднено.
Различные виды Ctenopoma, напротив, обладают высокой плодовитостью, однако не так популярны на рынке, потому что имеют тусклую окраску. Как правило, они существуют в коллекциях любителей
В рыборазводческой индустрии, помимо чистых линий, существует несколько мутаций, гибридов и вариаций. Мутации являются наследуемыми чертами и не получаются в результате межвидовых скрещиваний. Фактически, наиболее популярные особи гурами имеют мутации. Например, можно назвать альбиносную форму Macropodus opercularis, Anabas testudineus – желтую форму (избыток желтого пигмента), Trichogaster Trichopterus – золотую и серебряную формы, а также жёлтую и черную формы Betta splendens (Richter, 1988).
Вариации получаются при селекции родительских особей по необходимым признакам с последующим их закреплением в поколениях. Карликовый гурами является хорошим примером создания вариаций различной интенсивности и модели окраски. Гибриды создаются при скрещивании различных видов. Они приобретают часть признаков от одного и другого родителя, либо только от доминантной особи. Многие гибриды стерильны, поэтому каждый раз их придется выводить от генетически чистых производителей. Наилучшим примером гибридов среди лабиринтовых являются некоторые представители Betta sp..
Плодовитость мраморного гурами
Данные о плодовитости Trichogaster Trichopterus разнятся от 300-400 до 1000 икринок (Pethiyagoda, 1991), у других свыше 4000 (Richter, 1988). В среднем разводчики ориентируются на среднее значение, обычно 500, для определения количества производителей. Подобно другим рыбам, у гурами существует корреляция между размером тела и числом производимых личинок. Согласно Degani (1989), нет связи между размерами гнезда и массой рыбок, однако имеется связь между количеством потомства и массой самки. Кроме того, чем крупнее гнездо, тем больше будет личинок. Мелкое гнездо может говорить о неопытности самца или он ещё не вошел в такое состояние нереста, что готов стимулировать самку к икрометанию. В ряде работ отмечалась способность самок выделять половые феромоны, с помощью которых самец может распознавать зрелую и незрелую женскую особь (McKinnon and Liley, 1987, Pollak et al., 1978, Lee and Ingersoll, 1979). Pollack et al., 1978 проводил эксперименты, в которых прижигал или ампутировал хемочувствительные области около брюшных плавников у самцов видов Trichogaster. Такие особи редко строили гнездо или успешно размножались (Pollak et al. 1978).
Имеются данные, что самки успешно размножаются в природе несколько раз за сезон (Pollak et al. 1978). В условиях неволи Trichogaster Trichopterus продуцируют много икринок. Они практически не ограничены сроками между икрометанием. Мужские и женские особи готовы к новому нересту через 24 часа после предыдущего. Рыборазводческие фермы в состоянии разводить гурами каждые 2-6 недель в зависимости от выбранного вида. Самки мечут икру дважды за 24-78 часовой период. Тем не менее, часто они выделяют неоплодотворенные икринки. Данный механизм призван освободить яичники от созревших яиц, и его часто связывают с появлением большого количества капель жира на поверхности воды (Pollak et al. 1978).
Температура и освещение
В тропическом регионе, как температура, так и продолжительность освещения не претерпевают сезонных изменений. Строительство гнезда и икрометание отмечаются при температуре 23-29°C (Degani, 1989). При 20°C нерест уже не наблюдается, а 18°C может оказаться губительной. В темноте нерест у рыбок начинается позднее, но происходит чаще, чем при освещении.
Качество воды для разведения мраморного гурами
Виды Trichogaster характеризуются толерантностью и высокой адаптивной способностью. В природе они живут в воде с различными водными показателями (Inger 1962). Например, Geisler et al. 1979, осматривая три ручья в Таиланде, обнаружил присутствие там гурами. При этом отмеченные области различались не только субстратом (от песчаного до каменистого), но также гидрохимическими показателями. Проводимость воды составляла – 22-718 мкСм/см, общая жесткость — 1.3-185 мгл CaCo3, pH – 5.8-7.4 (Geisler et al. 1979).
| Показатели | Значения |
| Температура | 23-29°C |
| Жесткость | 50-100 мг/л CaCO3 |
| Соленость | 0 ‰ |
| pH | 6.8-8.0 |
| Нитриты | <0.5 мг/л |
| Нитраты | <0.5 мг/л |
| Аммоний | <1.0 мг/л |
| Кислород | >2.0 мг/л |
|
Содержание фитопланктона |
по диску Секки — 20-30 мм |
Рекомендуемые показатели воды
Разведение мраморного гурами в аквариуме
Разведение гурами можно разделить на несколько этапов, четкое соблюдение которых поможет достичь синхронизации нереста и получить большое количество мальков.
1. Определение пола. Самцы гурами характеризуются длинным спинным плавником, тянущимся до основания хвостового. Во многих случаях они также ярче окрашены. Самки тусклые, имеют короткий спинной плавник, и их брюшко более округлое. Маточное стадо отбирается на основе размеров, интенсивности окраски особей и созреванию у самок икры (у которых брюшко более округлое).
2. Производители самцы и самки помещаются в отдельный аквариум (12 литров на особь). В день производится замена 10% воды. Рыбок кормят три раза в день сбалансированным рационом коммерческими кормами (более 32% белка, размер частиц – 1 мм), мотылем, зеленым горошком и шпинатом. Все не съеденные остатки удаляются.
3. После двух недель производители готовы к размножению. В нерестовую емкость (40 литров) раньше помещается самец (утром) для акклиматизации, а позднее днем (15-16 часов) самка. Чтобы не тревожить рыбок, необходимо затемнить аквариум и не шуметь рядом с ним. В большинстве случаев, самец начинает строить гнездо через 2-3 часа. В случае видов рода Trichogaster не нужно добавлять в емкость предметы, например, плавающие кольца, куски пенопласта или растения для облегчения строительства. Нерестовик должен быть голым без аэрации, которая препятствует строительству гнезда.
4. Нерест продолжается от 1 до 4 дней. Иногда бывает сложно определить икринки в гнезде, потому что они практически такого же диаметра, как и пузырьки. Однако икринки имеют темно-золотистый или коричневатый оттенок. После икрометания во избежание агрессивных нападок самца на самку, её удаляют. В свою очередь, самец остается около кладки и заботится о потомстве до момента, пока не появятся мальки.
5. При температуре 27°C инкубационный период длится около 24 часов. Выклюнувшие личинки остаются в пузырьках до полного рассасывания желточного мешка. Мальки переходят к свободному плаванию через 4-5 дней и уже имеют длину 5-6 мм. Когда поисковое поведение молоди активизируется, они готовы к кормлению.
6. Удаляют самца. На данном этапе мальки крайне хрупкие и с ними необходимо обращаться очень бережно. Манипуляции с емкостью производят утром, при этом не допускают резких скачков температуры, pH и освещения. При помощи сифона с размером входных ячеек не более 100 мкм сливают воду до уровня 2-4 см. Затем переносят аквариум целиком в выростную емкость (пруд) и постепенно доливают его до краев, чтобы температура сравнялась. После этого мальков выпускают в выростник.
7. На начальном этапе своего развития мальки питаются инфузорией, коловратками или молодью дафний. Стоит отметить, что питательная среда с высокой плотностью беспозвоночных должна быть заблаговременно подготовлена в выростном аквариуме или пруду. Для этого за 10 дней до пересадки молоди, в емкость добавляют удобрения (N:P:K – 1:3:0) в объеме 1мл/50 литров, способствующие активному развитию водорослей (необходимо 20-30 см по диску Секки). Среди кормовых объектов чаще всего используют коловраток видов — Brachious calyciflorus и B. Rubens и различные виды дафний.
Если желаемого водорослевого бума нет, то молодь придется кормить 2-3 раза в день науплиями артемии или коммерческими кормами.
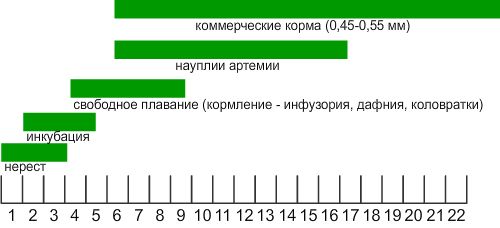
Этапы кормления и динамика развития молоди пятнистого гурами.
Развитие
При плотности посадки 0,5 малька на литр развитие гурами до размера 6-8 мм проходит за 12 недель. При более высокой плотности посадки, 2 малька на литр, эти размеры также могут достигаться за 12 недель, однако чаще сроки длиннее.
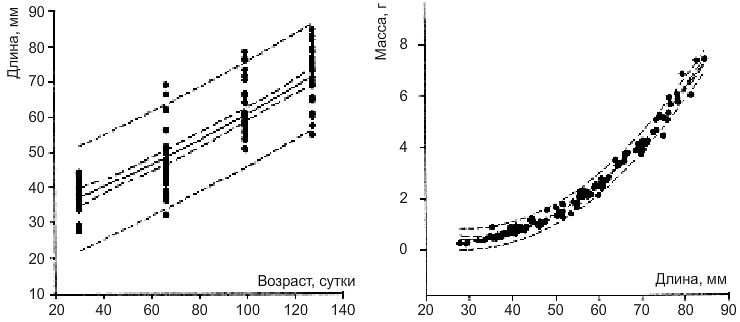
Динамика роста Trichogaster Trichopterus (слева) в течение 120 дней при плотности 2 особи/литр в емкости диаметром 0,6 метра и зависимость массы тела от длины (справа). Точками обозначены полученные данные, внутренними штрихпунктирными линиями — стандартное отклонение, а внешними — доверительный интервал.
В популяции наблюдаются высокий разброс в длине особей.
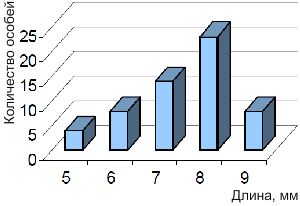
На рисунке показано распределение молоди гурами по размерам. Свыше 42% достигли длины 70-80 мм и 95% были длиннее 5 см.
Кормление
Trichogaster Trichopterus всеядный вид, его естественный рацион питания составляют беспозвоночные (Degani, 1990). В условиях интенсивного культивирования, где количество живого корма ограничено, для полноценного роста необходим сбалансированный рацион питания. Кроме того, следует вводить в корма различные добавки, улучшающие окраску рыбок. Среди них можно выделить – каротин, кантаксантин, астаксантин и ксантофилл. Максимальная абсорбция наблюдается у кантаксантина, применение которого повышает не только насыщенность окраски, но и радужность ксантофоров всего покрова. Данный пигмент обычно составляет 0,05 % от кормовой смеси (Fey and Meyers 1980). Рыбок кормят дважды в расчете 3-5% от массы тела/день. Эксперименты, проведенные Degani, 1990, показали, что скорость роста не зависит от того, питаются ли мальки коммерческими кормами, дрожжами или яичным желтком. Однако на ростовые показатели значительный эффект оказывает качество воды. Повышение уровня нитратов и нитритов сильно снижает темпы развития.
——
по информации: Brian Cole, M.S., Clyde S. Tamaru, Ph.D., Richard Bailey, B.A. A Manual for Commercial Production of the Gourami, Trichogaster Trichopterus, A Temporary Paired Spawner. Center for Tropical and Subtropical Aquaculture Publication Number 135. 1999.
1. Alfred E.R. 1962, Notes on a Collection of Fresh- Water Fishes from Penang. Bull. Sing Nat. Mus. 30 (Dec): 147-153.
2. Axelrod H.R., Burgess W.E., Pronek N. and Walls, J.G. 1993. Dr. Axelrods Atlas of Freshwater Aquarium Fishes, 7th ed. Neptune City, NJ: TFH Publications. 978.
3. Chapman F.A, S. Fitz-Choy E. Thurnberg J.T. Rodrick, C.M Adams and M. Andre, 1994. Analysis of the United States Of America International Trade in Ornamental Fish. 54 pp. Unpublished manuscript.
4. Deganl G. 1989. The Effect of Temperature, Light, Fish Size and Container Size on Breeding of Trichogaster trichopterus. Bamidgeh 41(2): 67-73.
5. Degani G. 1990. Effect of Different Diets and Water Quality on the Growth of the Larvae of Trichogaster trichopterus (B&S 1801). Aquacult. Engin. 9: 367-375.
6. Degani G., Boker R., Gal E., Vaya J., Jackson K., Marmelstein, G., Galill, N., Becker, D.,
7. Schreibman M.P., and Avraham M., 1992. Male Control of Reproduction in Female (Asynchronous Multi-Spawning ) Trichogaster trichoptertus (Pallas, 1797). Bamidgeh 44 (4) 132.
8. Fey M., Meyers S.P. 1980. Evaluation of Carotenold-Fortified Flake Diets with the Pearl gourami Trichogaster leeri. J. Aquaculture. 1(1): 16-19.
9. Frankel J. S. 1992. Inheritance of Trunk Coloration in the Three-Spot Gourami, Trichogaster trichopterus ( Pallas). J. Fish. Bio. 41:4 663-665.
10. Fulks W. and Main K. L editors. Rotifer and Microalgae Culture Systems. Proceedings of a U.S. — Asia Workshop. January 28 — 31, 1991-1 Honolulu, HI 364 p. Oceanic Institute, Honolulu HI.
11. Geisler R., Schmidt G.W., and Sookvibul S. 1979. Diversity and Biomass of Fishes in Three Typical Streams in Thailand. Int. Revue ges Hydrobiol. 64(5): 673-697.
12. Hoff F.H and Snell T.W 1989. Plankton Culture Manual. Florida Aqua Farms, Inc., Dade City, Fla.
13. Inger I.F. 1962. The Freshwater Fishes of Northern Borneo. Fieldiana Zoo. 45: 156-259.
14. lvleva I.V. 1973. Mass Cultivation of Invertebrates. Keter Press, Jerusalem.
15. Lee C.T., Ingersoll D.W. 1979. Social Chemosignals in Five Belontiidae (Pices) Species. J. Comparative and Physiological Psychology. 93(6): 1171-1181.
16. McKinnon J. S., Liley N.R. 1987. Asymmetric Species Specificity in Response to Female Sexual Pheromone by Males of Two Species of Trichogaster (Pisces: Belontildae). Can. J. Zool. 65: 1129-1134.
17. Pethiyagoda R., 1991. Freshwater Fishes of Sri Lanka. Wildlife Heritage Trust of Sri Lanka. pp 270.
18. Pollak E.I,.Thompson T., and Keener D. 1978. Spontaneous Egg-Release in the Blue Gourami (Trichogaster trichopterus). Animal Behav. 26(4): 1275.
19. Pollak E.1, Becker L.R. and Haynes K. 1978. Sensory Control of Mating in the Blue Gourami Trichogaster trichopterus (Pisces, Belontildae). Behav. Biol. 22: 92-103.
20. Pollak E-I., Thompson T., Stabler A. L., and Keener D., 198 1, Multiple Matings in the Blue Gourami Trichogaster trichopterus (pisces, Beloniidae).Anim. Behav. 29(1): 55-63.
21. Post G. 1987. Textbook of Fish Health. T.F.H Publications, Inc. Ltd., Neptune City, NJ.
22. Richter, 1988. Gouramis and Other Anabantoids. T.F.H Publications, Inc, Ltd., Neptune City, NJ
23. Scheurmann 1. 1990. Aquarium fish Breeding. Barons Educational Series Inc. Hauppauge, N.Y.
Похожие статьи:
Медовый гурами — Макроподовый медового окраса
Пятнистый или мраморный гурами
Аквариумная рыбка лялиус