Понятие пробиотик в основном используется в отношении бактерий, которые способны укреплять здоровье других организмов. Лиллей и Стиллвелл (Lilley and Stillwell, 1965) описали вещества, секретируемые микроорганизмами, которые стимулировали развитие хозяина. Таким образом, пробиотиками называют живые микроорганизмы, потребление которых в адекватных количествах благотворно сказывается на здоровье хозяина (FAO/WHO, 2001).
Пробиотические штаммы выделяются из врожденной или экзогенной микрофлоры водных животных. Грамотрицательные факультативные бактерии, такие как Vibrio и Pseudomonas составляют значительную часть микрофлоры морских видов рыб (Onarheim et al., 1994). В свою очередь, микрофлора пресноводных видов рыб представлена родами Aeromonas, Plesiomonas, семействами Enterobacteriaceae и облигатными анаэробными бактериями рода Bacteroides, Fusubacterium и Eubacterium (Sakata, 1990). Молочнокислые бактерии, доминирующие в кишечнике млекопитающих или птиц (Bifidobacterium у человека, Lactobacillus у свиней, кроликов и птиц, Enterococcus у насекомоядных), обычно в незначительной степени представлены у рыб родом Carnobacterium (Ringø and Vadstein, 1998).
Важно отметить, что состав врожденной микрофлоры зависит от генетических, пищевых факторов и условий окружающей среды. Тем не менее, микроорганизмы, представленные у водных животных, в гораздо большей степени влияют на здоровье их хозяев, чем у наземных животных и человека. Для поддержания стабильности процессов пищеварения кишечная микрофлора гидробионтов, вероятно, основывается на врожденной микрофлоре в купе с искусственно высоким уровнем аллохтонных микроорганизмов (Hansen and Olafsen, 1989).
Содержание
Механизм действия
Одним из важнейших факторов, который позволяет пробиотикам снижать выраженность и длительность заболевания, является повышение сопротивляемости и ингибирование колонизации патогенными микроорганизмами. Пробиотики ингибируют патогенную микрофлору, как в условиях целостного организма, так и in vitro, используя различные механизмы. К их числу относятся конкурентное исключение (Garriques and Arevalo, 1995; Moriarty, 1997; Gomez-Gil et al., 2000; Balca´zar, 2003; Balca´zar et al., 2004; Vine et al., 2004a); источник питательных веществ и ферментов для пищеварения (Sakata, 1990; Prieur et al., 1990; Garriques and Arevalo, 1995); прямой захват растворенных органических веществ, выделяемых бактериями (Garriques and Arevalo, 1995; Moriarty, 1997); а также исследуемые в настоящее время повышение иммунитета против патогенных микроорганизмов (Andlid et al., 1995; Scholz et al., 1999; Rengpipat et al., 2000; Gullian and Rodrý´guez, 2002; Irianto and Austin, 2002; Balca´zar, 2003; Balca´zar et al., 2004) и антивирусная активность (Kamei et al., 1988; Girones et al., 1989; Direkbusarakom et al., 1998).
Конкурентное исключение
Очень распространенным феноменом в природе является антагонистическое отношение различных штаммов бактерий друг к другу. Равновесие, которое наблюдается в желудочно-кишечном тракте между полезной и патогенной микрофлорой, определяется взаимодействием бактерий. Однако в условиях рыбоводства и в зависимости от факторов окружающей среды происходит стимуляция развития конкретных видов бактерий. Хорошо известно, что микрофлора кишечника водных организмов может быть изменена, например, при кормлении их другими микроорганизмами. Подобная практика помогает снизить или предотвратить многие болезни (Balcazar, 2002).
Первое сообщение о существовании бактерии, которая ингибирует развитие Vibrio sp. было представлено Гайсом (Gaixa, 1889) при изучении морских видов рыб. Позднее, Розенфилд и Зобелл (Rosenfeld и Zobell, 1947) описали микроорганизмы, продуцирующие антибиотики. Именно с этого время началось активное изучение биологических агентов.
В аквакультивировании было продемонстрировано ингибирующее действие Thalassobacter utilis на вибрионы Vibrio anguillarum. Данный штамм повышал выживаемость личинок краба Portunus trituberculatus, а также снижал число возбудителей Vibrio anguillarum в воде, используемой для выращивания личинок (Nogami and Maeda, 1992; Nogami et al., 1997). Позднее исследователи показали, что бактериальные штаммы, связанные с кишечной или эпидермальной слизью взрослых особей тюрбо (Scophthalmus maximus) или ершоватки (Limanda limanda) подавляли развитие паразита V. anguillarum (Olsson et al., 1992). Использование Vibrio alginolyticus в качестве пробиотика в хозяйствах Эквадора было рекомендовано для повышения выживаемости и скорости роста белой креветки (Litopenaeus vannamei) после перехода от личиночной стадии развития. Конкурентное исключение потенциально патогенной бактерии снижало или исключало необходимость в антибактериальной профилактике, обычно проводимой при интенсивном выращивании личинок (Garriques and Arevalo, 1995). Сравнительно недавно из эстуария были выделены морские бактерии Pseudomonas I2, которые секретировали вещество, обладающее ингибирующим эффектом на патогенные вибрионы креветок. Данное соединение имеет низкую молекулярную массу, теплоустойчиво, растворяется в хлороформе и стойкое к протеолитическим ферментам (Chythanya et al., 2002).
Источник питательных веществ и ферментов для пищеварения
Ряд исследователей отмечают благотворное влияние микроорганизмов на процессы пищеварения у водных животных. У рыб подобными эффектами, в частности, на обмен жирных кислот и витаминов, обладают Bacteroides и Clostridium sp. (Sakata, 1990). Такие бактерии как Agrobacterium sp., Pseudomonas sp., Brevibacterium sp., Microbacterium sp., и Staphylococcus sp. участвуют в пищеварении Арктического гольца (Salvelinus alpinus L.) (Ringø et al., 1995).
У двустворчатых моллюсков некоторые бактерии секретируют внеклеточные ферменты, протеазы, липазы и ростовые факторы и, тем самым, вовлекаются в процесс пищеварения (Prieur et al., 1990). Подобные результаты были получены при изучении микрофлоры взрослых Китайских белых креветок (Penaeus chinensis), которые вырабатывали ферменты для пищеварения и вещества, усваиваемые особью (Wang et al., 2000). Микрофлора может быть, как дополнительным источником пищи и помощником в процессах пищеварения, так и источником незаменимых аминокислот и витаминов (Dall and Moriarty, 1983).
Воздействие на качество воды
Улучшение качества воды связано с активностью Bacillus sp.. Объяснение этому строится на том, что грамположительные бактерии лучше перерабатывают органическую массу в углекислый газ, чем грамотрицательные бактерии. В процессе производственного цикла большое количество грамположительных бактерий может минимизировать возросшую концентрацию растворенного и осажденного органического углерода. Согласно докладу (Dalmin et al., 2001), использование Bacillus sp. улучшает качество воды, выживаемость, скорость роста и здоровье молоди Penaeus monodon, а также снижает количество патогенных вибрионов.
Укрепление иммунитета
Пробиотики способны стимулировать неспецифический иммунитет, что было продемонстрировано в экспериментах с оральным введением бактерий Clostridium butyricum радужной форели. У особей, находящихся на специальной диете, повышалась устойчивость в вибриозу, благодаря возрастанию фагоцитарной активности лейкоцитов (Sakai et al., 1995). В своей работе Рингпипат с коллегами (Rengpipat et al., 2000) ссылались на тот факт, что использование Bacillus sp. (штамм S11) обеспечивает защиту за счет активации как гуморального, так и клеточного иммунитета тигровой креветки (P. monodon). Балказар (Balcazar, 2003) продемонстрировал положительный эффект смеси бактериальных штаммов (Bacillus и Vibrios sp.) на скорость роста и выживаемость при её введении молоди белой креветки. У экспериментальных животных также наблюдался иммунитет к Vibrio harveyi и вирусу синдрома белых пятен, который определялся увеличением фагоцитарной и антибактериальной активности. В другом исследовании (Nikoskelainen et al., 2003), введение с пищей молочнокислых бактерий Lactobacillus rhamnosus (штамм ATCC 53103) в концентрации 105 cfu г-1 (cfu — число единиц формирующих колонию) приводило к росту дыхательной активности лейкоцитов у радужной форели (Oncorhynchus mykiss).
Антивирусная активность
Некоторые бактерии исследуются на предмет антивирусной активности. Хотя точный механизм, с помощью которого они проявляют свои эффекты, неизвестен, лабораторные тесты показывают, что инактивация вирусов происходит при воздействии химических и биологических веществ, таких как вытяжка из морских водорослей и внеклеточных агентов бактерий. Докладывалось об антивирусной активности штаммов Pseudomonas sp., Vibrios sp., Aeromonas sp. и группы коринеформных бактерий, выделенных из воды инкубаторной станции для лососевых против инфекционного некроза гемопоэтической ткани (Kamei et al., 1988). Джиронес с коллегами (Girones et al., 1989) сообщили, что морские бактерии, предварительно отнесенные к роду Moraxella, обладают антивирусной активностью с высокой специфичностью к полиовирусу. Позднее были выделены два штамма Vibrio spp. NICA 1030 и NICA 1031 из инкубатора с черными тигровыми креветками. Эти образцы имели высокую (снижение бляшек на 62-99%) эффективность против инфекционного некроза гемопоэтической ткани лососевых у Oncorhynchus masou (Direkbusarakom et al., 1998).
Колонизация
Колонизация желудочно-кишечного тракта (ЖКТ) пробиотиком возможна только после рождения животного и до момента установления конкурентной врожденной микрофлоры. В противном случае, лишь высокие дозы пробиотика способны временно искусственно сместить равновесие. У взрослых животных популяция пробиотических организмов в ЖКТ сильно снижается в течение нескольких дней после того как прекращается кормление их специальным рационом (Fuller, 1992).
Согласно Конвей (Conway, 1996), микроорганизм способен колонизировать ЖКТ, если он длительное время сохраняется там, размножаясь со скоростью, превышающей скорость его изгнания. Например, Vibrio sp. обычно колонизирует гепатопанкреас молоди белой креветки. Тем не менее, данная микрофлора может быть искусственно модифицирована внесением в воду в течение 20 дней культуры Bacillus sp. (свыше 50% от общего числа кишечной микрофлоры) (Gullian and Rodrýguez, 2002).
Процесс захвата характеризуется прилипанием бактерий к слизистой кишечника и последующим их погружением в слизистый гель или прикреплением к эпителиальным клеткам. Адгезия и колонизация слизистой поверхности является возможным механизмом защиты от патогенных организмов, благодаря конкуренции за участки связывания и питательные вещества (Westerdahl et al., 1991), либо иммуномодуляции (Salminen et al., 1998).
На степень колонизации влияют несколько факторов: 1. Связанные с особенностями хозяина (температура тела, окислительно-восстановительный потенциал, состав ферментов и генетическая сопротивляемость). Например, бактерия может попасть в организм через рот с водой или пищей и пройти через ЖКТ, где их часть останется в качестве резидентной микрофлоры. Другие будут уничтожены в процессе пищеварения или пройдут через кишечник и выйдут с фекалиями. Кроме того, развитие бактерий может угнетаться специальными веществами, производимыми хозяином; 2. Связанные с особенностями микроорганизма (эффект антагонизма бактерий, образующих протеазы, бактериоцины, лизоцимы, перекись водорода, соединения аммония, диацетила и изменяющих pH среды при действии различными кислотами) (Dopazo et al., 1988; Gram et al., 1999; Chythanya et al., 2002; Sugita et al., 2002; Gullian et al., 2004). Например, молочнокислые бактерии известны своей способностью продуцировать вещества, в частности, бактериоцины, которые подавляют развитие других микроорганизмов.
Выбор пробиотиков
Традиционным методом подбора пробиотика является проведение теста на антогонизм, в котором патогенный агент помещается вместе с предполагаемым пробиотиком на жидкую (Sotomayor and Balcazar, 2003; Vine et al., 2004a) или твердую (Dopazo et al., 1988; Chythanya et al., 2002) среды. С другой стороны, Грэм (Gram et al., 1999) отмечал, что активность в условиях in vitro в питательной среде не может использоваться для предсказания поведения пробиотика в условиях целостного организма. В частности, антагонизм Pseudomonas fluorescens (штамм AH2) в отношении Aeromonas salmonicida, наблюдавшийся в условиях in vitro, не был подтвержден для атлантического лосося, который не проявлял устойчивость к фурункулезу. Однако штамм оказался эффективным при его введении радужной форели, демонстрирующей защиту от вибриоза (Gram et al., 2001). Кроме того, важно знать происхождение (предпочтительно использовать штаммы, выделенные из хозяина), безопасность (патогенность) и способность штамма выносить перенос через ЖКТ хозяина (устойчивость солям желчи, низкой кислотности и протеазам). Степень колонизации часто рассматривается как один из критериев отбора пробиотика, потому что она служит показателем эффективности прикрепления к эпителию или предотвращения заражения патогенным агентом (Vine et al., 2004b). В качестве дополнительных факторов отбора выступают повышение иммунитета и обеспечение хозяина питательными веществами. Наконец, пробиотик должен сохранять свои свойства в условиях обычного хранения и легко готовиться (быть растворимым).
Немаловажным является вопрос использования полезных бактерий. Их можно вводить животным при добавлении в живой (Gomez-Gil et al., 1998) или искусственный корма (Rengpipat et al., 2000); с помощью ванн (Austin et al., 1995; Gram et al., 1999); добавлением в воду с культурой (Moriarty, 1998; Spanggaard et al., 2001). Например ежедневное заражение аквариума с личинками белой креветки (L. Vannamei) пробиотиком плотностью 105 cfu мл-1 предотвращало колонизацию патогенными организмами (Peeters and Rodrýguez, 1999).
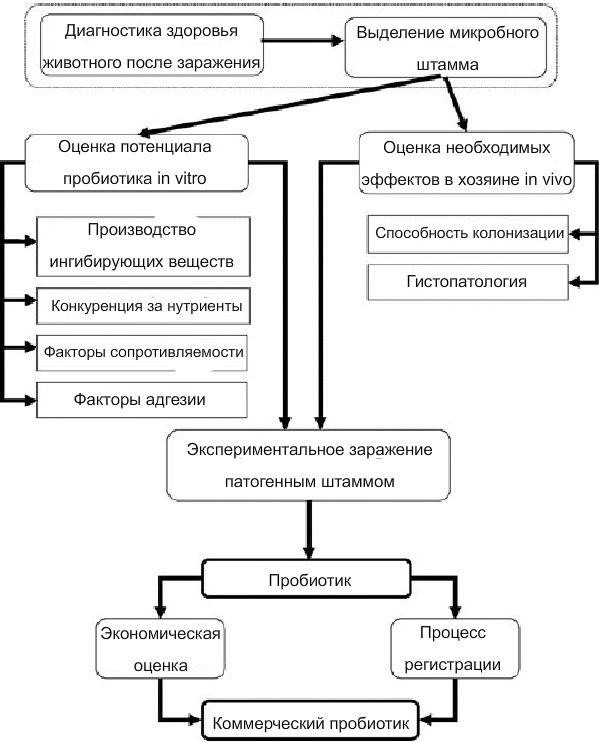
На иллюстрации показан процесс отбора пробиотика
Рассмотрение контроля за пробиотиками
| Пробиотики |
| Bacillus cereus var. toyoi Bacillus licheniformis Bacillus subtilis Enterococcus faecium Lactobacillus casei Lactobacillus farciminis Lactobacillus plantarum Lactobacillus rhamnosus Pediococcus acidilactici Saccharomyces cerevisiae Streptococcus infantarius |
Таблица 1. Микроорганизмы, разрешенные к применению в аквакультивировании согласно Директивы Совета 70/524/EEC.
Последние несколько лет нормы использования пищевых добавок были консолидированы в Европейском Союзе. В качестве добавок выступают пищевые продукты, которые обеспечивают защиту здоровья человека или животного и гарантируют безопасность потребителя.
Недавно некоторые микроорганизмы были узаконены для их применения в качестве пробиотиков (Таблица 1).
Штаммы пробиотиков, исследуемые в аквакультуре
Большинство пробиотиков, используемых в аквакультивировании, принадлежат к молочнокислым бактериям (Lactobacillus и Carnobacterium), роду Vibrio (V. alginolyticus), роду Bacillus, либо Pseudomonas, хотя другие рода или виды также могут быть задействованы (Aeromonas и Flavobacterium) (Таблица 2).
|
Штамм пробиотика |
Источник |
Использоваан на |
Метод введения |
|
Streptococcus lactis and |
? |
личинки тюрбо(Scophthalmus |
рацион с обогащенным живым |
|
Lactobacillus sp. and |
коловратки (Brachionus |
личинки тюрбо |
рацион с обогащенными |
|
Vibrio alginolyticus |
хозяйство по разведению |
атлантический лосось (Salmo |
ванна в растворе с бактериями |
|
Carnobacterium divergens |
ЖКТ атлантического лосося |
мальки атлантической трески |
добавление в рацион питания |
|
Bacillus megaterium, B. |
коммерческий продукт |
канальный сом |
добавление в воду |
|
Vibrio pelagius |
личинки тюрбо |
тюрбо |
|
|
G-probiotic |
коммерческий продукт |
Oreochromis niloticus |
добавление в рацион питания |
|
Pseudomonas fluorescens |
замороженная пресноводная |
радужная форель (Oncorhynchus |
добавление в воду |
|
Carnobacterium sp. |
ЖКТ атлантического лосося |
атлантический лосось |
добавление в рацион питания |
|
Lactobacillus rhamnosus ATCC |
культура |
радужная форель (Oncorhynchus |
|
|
Aeromonas hydrophila, Vibrio |
ЖКТ радужной форели |
радужная форель (Oncorhynchus |
|
|
Enterococcus faecium SF68 |
коммерческий продукт |
Anguilla anguilla |
|
|
L. rhamnosus JCM 1136 |
культура |
радужная форель (Oncorhynchus |
|
|
Roseobacter sp. strain 27-4 |
личинки тюрбо, личинки |
личинки тюрбо |
добавление в воду |
|
Bacillus circulans |
кишечник Labeo rohita |
L. rohita |
добавление в рацион питания |
|
Ракообразные |
|||
|
Bacillus sp. S11 |
Penaeus monodon |
P. monodon |
добавление в рацион питания |
|
Bacillus sp. |
коммерческий продукт (DMS) |
P. monodon |
добавление в воду |
|
Lactobacillus spp. |
ЖКТ курицы |
P. monodon |
добавление в рацион питания |
|
Saccharomyces cerevisiae, S. |
коммерческий продукт |
Penaeus vannamei |
|
|
Vibrio hepatarius, Vibrio |
P. vannamei |
P. vannamei |
|
|
Vibrio P62, Vibrio P63, |
P. vannamei |
P. vannamei |
добавление в воду |
|
Pseudomonas sp., Vibrio |
P. monodon |
P. monodon |
|
|
Моллюски |
|||
|
Aeromonas media strain A199 |
? |
Crassostrea gigas |
|
|
Roseobacter sp. BS107 |
культура личинок гребешка |
Pecten maximus |
|
|
Alteromona haloplanktis |
культура микроводорослей |
Argopecten purpuratus |
|
|
Живой корм |
|||
|
Flavobacterium sp. |
культура Chaetoceros gracilis |
C. gracilis, |
|
|
Lactococcus lactis AR21 |
культура коловраток |
коловратки |
|
|
V. alginolyticus C7b |
морская вода |
Chaetoceros muelleri |
|
|
Pediococcus acidilactici |
коммерческий продукт |
артемия |
|
|
Lactobacillus casei, L. |
культура |
науплии артемии |
|
Таблица 2.
Пробиотики, исследуемые в аквакультуре.
Икра рыб и личинки
Развитие икры и ранние этапы развития личинок рыб могут иметь важное значение в развитии микробного сообщества. Последнее, в свою очередь, также воздействует на рыб за счет неорганических и органических соединений.
Непосредственно после вылупления личинки входят в контакт с окружающей средой, которая населена множеством различных бактерий, активно вовлекающихся в колонизацию личинок. Известно, что здоровье мальков и, в частности, первичная колонизация их внутренней микрофлоры, зависит от того, какая микрофлора окружала икринки. При интенсивном культивировании количество бактерий стремительно возрастает в воде с 103 мл-1 перед вылуплением до 106 мл-1 после появления личинок (Hansen and Olafsen, 1989).
Состав микрофлоры зависит от многих факторов, включая доступность питательных веществ, физиологии животного и иммунологические факторы. В нормальных условиях одной из основных физиологических функций резидентной микрофлоры является постановка микробного барьера против патогенных организмов, а также обеспечение дополнительных ферментов для пищеварения.
На этапе питания мальков стартовым кормом имеется возможность искусственно устанавливать доминирующую группу бактерий, благодаря введению специальных штаммов. Например, средняя масса тела личинок тюрбо (S. maximus) значительно возрастала по сравнению с контрольной группой при кормлении их коловратками, обогащенными молочнокислыми бактериями, которые обеспечивали защиту от патогенных вибрионов (Vibrio) (Gatesoupe, 1994).
Аналогично, введение Carnobacterium divergens привело к возрастанию сопротивляемости мальков трески (G. morhua) против V. anguillarum (Gildberg and Mikkelsen, 1998).
В работе с личинками тюрбо была продемонстрирована антибактериальная активность 34 штаммов из 400 морских бактерий против V. anguillarum, Vibrio splendidus и Pseudoalteromonas. Данные штаммы относились к Roseobacter spp., Vibrio spp., и Pseudoalteromonas. Виды Roseobacter были признаны не смертельными для личинок тюрбо с желточным мешком, и в двух опытах их смертность значительно снижалась при обработке их 107 cfu мл-1 штаммом 27-4 (Hjelm et al., 2004).
Молодь рыб и взрослые особи
В экспериментах, проведенных Квирозом и Бойдом (Queiroz and Boyd, 1998), приготовленная смесь бактерий Bacillus spp. добавлялась в воду с канальным сомом (Ictalurus punctatus) и, таким образом, повышала их выживаемость и продуктивность хозяйства.
Штамм Carnobacterium sp., ранее выделенный из кишечника атлантического лосося, при добавлении в пищу в концентрации 5х107 клеток на г-1 оказался эффективным в отношении контроля инфекции, вызванной A.
salmonicida, Vibrio ordalii и Yersinia ruckeri у мальков и подросшей молоди лосося (Robertson et al., 2000).
Добавляемые в корм культуры Aeromonas hydrophila, Vibrio fluvialis, Carnobacterium sp. и неидентифицированные грамположительные кокков, продемонстрировали высокую эффективность в снижении фурункулеза у радужной форели (Irianto and Austin, 2002). Обработка атлантического лосося в ваннах с содержанием 108 клеток мл-1 штамма V. Alginolyticus в последствии снижала смертность особей от A. salmonicida и в меньшей степени от V. anguillarum и V. ordalii (Austin et al., 1995). Проведенные недавно исследования свидетельствуют в пользу того, что различные штаммы пробиотиков повышают устойчивость к инфицированию грибами. Например, Aeromonas media (штамм A199) в культуре угрей (Anguilla australis Richardson) обладают антагонистической активностью по отношению к Saprolegnia sp., подавляя его развитие (Lategan and Gibson, 2003).
При изучении кишечных бактерий Vibrio spp., выделенных из молоди и личинок азиатского паралихта (Paralichthys olivaceus), обнаружена их антибактериальная активность в отношении к Pasteurella piscicida (Sugita et al., 2002). Из желудка и кишечника рыбы клоуна (Amphiprion percula) было выделено 106 штаммов бактерий, при этом 5 из низ демонстрировали ингибирование A. hydrophila, A. salmonicida, V. harveyi, V. anguillarum, V. damsela, V. alginolyticus и C. piscicola (Vine et al., 2004a).
В фекальном экстракте молоди тюрбо развитие V. Anguillarum подавлялось клетками Carnobacterium. Наблюдения показали, что кишечник и фикалии тюрбо могут изобиловать V. Anguillarum, и использование пробиотика с антагонистической активностью позволит снизить вибриоз в хозяйствах (Olsson et al., 1998).
Штаммы, которые в основном используются в качестве человеческих пробиотиков (молочнокислые бактерии и энтерококки), исследовались с целью их применения в аквакультуре рыб. Введение радужной форели L. Rhamnosus в течение 51 дня снижало смертность от A. Salmonicida с 52,6% в контроле до 18,9 и 46,3% в опытных группах, которых кормили рационом с 109 клеток г-1 и 1012 клеток г-1, соответственно (Nikoskelainen et al., 2001). Также было показано, что выживаемость после заражения палочками Edwardsiella tarda речного угря (Anguilla anguilla L.), питающегося кормом с добавкой Enterococcus faecium (штамм SF68), значительно выше по сравнению с контрольной группой (Chang and Liu, 2002).
Ракообразные
В работе с использованием тигровой креветки инокуляция Bacillus S11, сапрофитного штамма, приводило к повышению выживаемости P. Monodon, которые заражались патогенной люминесцирующей культурой (Rengpipat et al., 1998). Смесь Lactobacillus spp., выделенная из ЖКТ кур, активизировала рост и повышала выживаемость молоди P. monodon, которые в течение 100 дней питались рационом, содержащим данный штамм (Phianphak et al., 1999).Недавно было показано, что развитие патогенного V. harveyi подавляется пробиотиком Bacillus subtilis BT23 в условиях in vivo и in vitro. Повышение сопротивляемости вибриону со стороны P. Monodon наблюдалось после 6 дневной ванны в воде с плотностью Bacillus subtilis BT23 – 106-108 клеток мл-1 и последующим заражением V. harveyi плотностью – 103-106 клеток мл-1 в течение 1 часа. Смертность креветок составила 10% (Vaseeharan and Ramasamy, 2003). Пробиотический эффект L. vannamei был продемонстрирован при использовании трех штаммов, выделенных из гепатопанкреаса креветок. Они были идентифицированы как Vibrio P62, Vibrio P63 и Bacillus P64, а процент их ингибирования вибриона V. harveyi S2 в условиях in vivo составил 83, 60 и 58%, соответственно. Гистологический анализ после колонизации продемонстрировал отсутствие у них патогенных эффектов (Gullian et al., 2004). За свою способность секретировать внеклеточные макромолекулярные пищеварительные ферменты Pseudomonas sp. PM 11 и V. fluvialis PM 17, выделенные из кишечника культивируемых тигровых креветок, являлись кандидатами на звание пробиотиков. Тем не менее, когда креветки обрабатывались данными микроорганизмами, оценка иммунологических показателей, таких как количество гемоцитов, фенолоксидазная и антибактериальная активность, имели неудовлетворительную тенденцию (Alavandi et al., 2004). Вероятно, эти бактерии не смоли колонизировать кишечник, поэтому не оказывали стимулирующее действие на иммунитет креветок. Известно, что колонизация кишечника специфичной микрофлорой играет роль в поддержании иммунной системы слизистой, которая вносит свой вклад сохранение иммунологической толерантности, либо подавляет деструктивные эффекты патогенных микроорганизмов внутри хозяина.
——
использованный источник: Balcázar J.L., de Blas I., Ruiz-Zarzuela I., Cunningham D., Vendrell D., Múzquiz J.L. The role of probiotics in aquaculture. Vet Microbiol. 2006; 114 (3-4):173-86.
Список литературы — https://aquavitro.org/img/probiotiki-v-akvakultivirovanii/probiotiki-v-akvakultivirovanii.jpg
Похожие статьи:
Убивающая американских сомов бактерия имеет азиатские корни
Бактериальное заболевание жабр
Бактериальные призраки в качестве вакцины для рыбок