 Аммиак является одним из наиболее серьезных и часто встречающихся веществ, отравляющих аквариумную воду. Рыбы и бактерии выделяют его в процессе метаболизма, при этом аммиак составляет 60-80% из всего числа выделяемых костными рыбами азотсодержащих соединений (20% мочевина). Как правило, в расчет берется общий уровень аммония, включающего неионизированную форму (NH3) и катион аммония (NH4+). В растворе, данные формы находятся в равновесном состоянии: NH3 + H2O -> NH4OH -> NH4+ + OH—.
Аммиак является одним из наиболее серьезных и часто встречающихся веществ, отравляющих аквариумную воду. Рыбы и бактерии выделяют его в процессе метаболизма, при этом аммиак составляет 60-80% из всего числа выделяемых костными рыбами азотсодержащих соединений (20% мочевина). Как правило, в расчет берется общий уровень аммония, включающего неионизированную форму (NH3) и катион аммония (NH4+). В растворе, данные формы находятся в равновесном состоянии: NH3 + H2O -> NH4OH -> NH4+ + OH—.
Содержание
Введение
Доля аммиака зависит от pH, солености и температуры среды. Обычно на каждую единицу прироста pH происходит десятикратное возрастание концентрации аммиака, образующегося при смещении равновесия в левую сторону. Например, при увеличении щелочности c 7 до 8 единиц доля азота в составе аммиака возрастает с 0,33 до 3,3%, в то время как доля азота в составе NH4+ падает с 99,7 до 96,7%. Таким образом, токсичность более выражена в щелочных условиях. Повышение температуры и солености также приводит к увеличению доли неионизированного NH3 [1].
|
Температура (°C) |
|||||||||||||
|
pH |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
24 |
26 |
28 |
30 |
|
7.0 |
.0013 |
.0016 |
.0018 |
.0022 |
.0025 |
.0029 |
.0034 |
.0039 |
.0046 |
.0052 |
.0060 |
.0069 |
.0080 |
|
7.2 |
.0021 |
.0025 |
.0029 |
.0034 |
.0040 |
.0046 |
.0054 |
.0062 |
.0072 |
.0083 |
.0096 |
.0110 |
.0126 |
|
7.4 |
.0034 |
.0040 |
.0046 |
.0054 |
.0063 |
.0073 |
.0085 |
.0098 |
.0114 |
.0131 |
.0150 |
.0173 |
.0198 |
|
7.6 |
.0053 |
.0063 |
.0073 |
.0086 |
.0100 |
.0116 |
.0134 |
.0155 |
.0179 |
.0206 |
.0236 |
.0271 |
.0310 |
|
7.8 |
.0084 |
.0099 |
.0116 |
.0135 |
.0157 |
.0182 |
.0211 |
.0244 |
.0281 |
.0322 |
.0370 |
.0423 |
.0482 |
|
8.0 |
.0133 |
.0156 |
.0182 |
.0212 |
.0247 |
.0286 |
.0330 |
.0381 |
.0438 |
.0502 |
.0574 |
.0654 |
.0743 |
|
8.2 |
.0210 |
.0245 |
.0286 |
.0332 |
.0385 |
.0445 |
.0514 |
.0590 |
.0676 |
.0772 |
.0880 |
.0998 |
.1129 |
|
8.4 |
.0328 |
.0383 |
.0445 |
.0517 |
.0597 |
.0688 |
.0790 |
.0904 |
.1031 |
.1171 |
.1326 |
.1495 |
.1678 |
|
8.6 |
.0510 |
.0593 |
.0688 |
.0795 |
.0914 |
.1048 |
.1197 |
.1361 |
.1541 |
.1737 |
.1950 |
.2178 |
.2422 |
|
8.8 |
.0785 |
.0909 |
.1048 |
.1204 |
.1376 |
.1566 |
.1773 |
.1998 |
.2241 |
.2500 |
.2774 |
.3062 |
.3362 |
|
9.0 |
.1190 |
.1368 |
.1565 |
.1782 |
.2018 |
.2273 |
.2546 |
.2836 |
.3140 |
.3456 |
.3783 |
.4116 |
.4453 |
|
9.2 |
.1763 |
.2008 |
.2273 |
.2558 |
.2861 |
.3180 |
.3512 |
.3855 |
.4204 |
.4557 |
.4909 |
.5258 |
.5599 |
|
9.4 |
.2533 |
.2847 |
.3180 |
.3526 |
.3884 |
.4249 |
.4618 |
.4985 |
.5348 |
.5702 |
.6045 |
.6373 |
.6685 |
|
9.6 |
.3496 |
.3868 |
.4249 |
.4633 |
.5016 |
.5394 |
.5762 |
.6117 |
.6456 |
.6777 |
.7078 |
.7358 |
.7617 |
|
9.8 |
.4600 |
.5000 |
.5394 |
.5778 |
.6147 |
.6499 |
.6831 |
.7140 |
.7428 |
.7692 |
.7933 |
.8153 |
.8351 |
|
10.0 |
.5745 |
.6131 |
.6498 |
.6844 |
.7166 |
.7463 |
.7735 |
.7983 |
.8207 |
.8408 |
.8588 |
.8749 |
.8892 |
|
10.2 |
.6815 |
.7152 |
.7463 |
.7746 |
.8003 |
.8234 |
.8441 |
.8625 |
.8788 |
.8933 |
.9060 |
.9173 |
.9271 |
Доля токсичной (неионизированной) формы NH3 в растворе при различных значениях кислотности и температуры среды [2].
Токсичность аммиака для рыб
Рыбки в различной степени реагируют на присутствие аммиака. В частности, летальная концентрация аммиака для радужной форели (Oncorhynchus mykiss) варьирует от 0,2 до 1.1 мг/л [1], тогда как для менее восприимчивого канального сома она составляет 1,8-3,8 мг/л [3].
|
Вид |
Концентрация NH3 (мг/л) |
|
Радужная форель (Oncorhynchus mykiss) |
0,32 |
|
Арктический голец (Salvelinus alpinus) |
0,03 |
|
Карп (Cyprinus carpio) |
2,2 |
|
Канальный сом (Ictalurus punctatus) |
3,1 |
Летальная доза аммиака для некоторых видов рыб [4]
Тепловодные рыбки традиционно более устойчивы по сравнению с холодноводными. В свою очередь, пресноводные виды менее восприимчивы, чем солоноводные.
К хроническим токсическим эффектам аммиака относится подавление репродуктивной функции, включая затягивание времени до начала нереста и снижение жизнеспособности икринок. Длительное воздействие NH3 (в течение 1 недели и до 3 месяцев) в концентрации 0,002-0,15 мг/л подавляет аппетит и развитие молоди. Среди других симптомов можно отметить снижение иммунитета, появление рванных краев у плавников или различного рода дефектов развития мальков, например, потерю жаберных крышек.
Во избежание хронического влияния аммиака рекомендуется не допускать повышение его концентрации больше 0,01-0,03 мг/л.
Ряд морфологических исследований жабр рыб после воздействия повышенной концентрации раствора, содержащего NH3/NH4+, указывают на деструктивные изменения, происходящие в жаберной ткани [11; 12]. В частности, при исследовании воздействия аммиака при различных значениях pH на жабры карпа (C. carpio) продемонстрировано токсическое влияние, приводящее к некрозу жабр, разрушению эпителиальных клеток и дегенеративным изменениям (гидрохимические показатели в контроле: растворенный кислород 6.2±0.02 мг/л; pH 7.2±0.2; температура воды 25.0±2.0°C; соленость 0.2±0.07 млн-1; общая жесткость 13±2.0 мг/л; кальций 5.0±0.1 мг/л; магний 8.0±2.0 мг/л и общая щелочность 20.0±06 мг/л). Полулетальная доза аммиака для особей при pH 5.0; 7.2 и 8.0 составляла 27; 22 и 18 млн-1/л, соответственно.
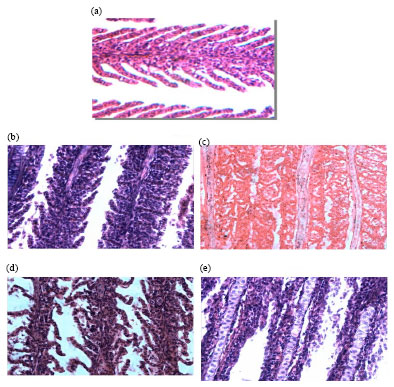
Поперечные срезы жабр Cyprinus carpio var. communis после выдерживания рыбок в аммонийном растворе (22 млн-1/л; pH — 7.2) в течение 96 часов (Увеличение х400). Контроль (a), спустя 24 часа (b), спустя 48 часов (c), спустя 96 часов (e) экспозиции [13].
У рыбок, выдерживаемых в растворе с повышенным содержанием аммиака при низком значении pH (5.0; концентрация 27 млн-1; выдерживание в течение 96 часов), наблюдалось отслоение эпителия, отек, гиперплазия, гипертрофия и пролиферация хлоридных клеток (иллюстрация ниже).
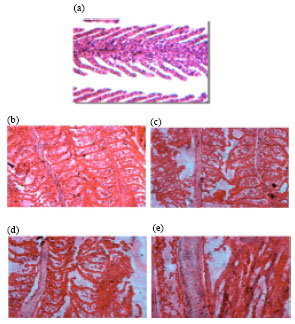
Поперечные срезы жабр Cyprinus carpio var. communis после выдерживания рыбок в аммонийном растворе (27 млн-1/л; pH — 5.0) в течение 96 часов (Увеличение х400). Контроль (a), спустя 24 часа (b), спустя 48 часов (c), спустя 96 часов (e) экспозиции [13].
В свою очередь, при высоких значениях pH (8.0; концентрация аммиака 18 млн-1; выдерживание в течение 96 часов) экспозиция в растворе приводила к плавлению лепестков второго порядка, шелушению эпителия, кровоизлиянию и полному разрушению эпителиальных клеток лепестков (иллюстрация ниже). Результаты указывают на то, что в условиях повышенной щелочности раствор NH3/NH4+ проявляет наибольшую токсичность [13].
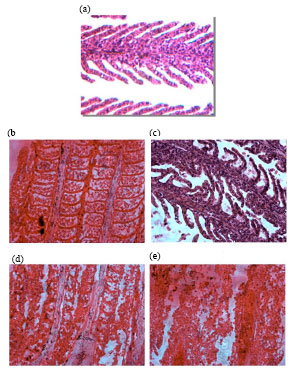
Поперечные срезы жабр Cyprinus carpio var. communis после выдерживания рыбок в аммонийном растворе (18 млн-1/л; pH — 8.0) в течение 96 часов (Увеличение х400). Контроль (a), спустя 24 часа (b), спустя 48 часов (c), спустя 96 часов (e) экспозиции [13].
Механизм токсического действия
Понимание токсического влияния NH3/NH4+ невозможно без объяснения механизма диффузии этих соединений в биологических тканях рыб и их деструктивного влияния.
Известно, что у большинства видов рыб, за исключением морских костных и миног, диффузия NH4+ минимальна, вследствие слабой проницаемости к ним жаберного эпителия [14]. Однако в незначительной степени данный ион может проникать через мембрану за счет градиента электрического потенциала. Благодаря наличию заряда, он обладает аналогичным как у катиона K+ ионным радиусом и гидратной оболочкой и способен заменять его, и по некоторым сведениям Na+, при прохождении Na+/K+-АТФ-азного насоса и Na+/2CL—/K+ контранспортера [15].
С другой стороны, NH3 растворяет липидный слой и активно диффундирует через эпителий по градиенту концентрации, а также через аквапорины [16]. Это подтверждается рядом фактов:
1. Умеренное снижение pH среды приводит к возрастанию выделения аммиака у радужной форели, карпа и золотой рыбки;
2. Увеличение pH среды, и, следовательно, доли NH3 за счет потери протонов, приводит к снижению выделения аммиака у радужной форели;
3. Инъекции аммония в составе солей NH4Cl и (NH4)2SO4 вызывает усиление экскреции аммиака у радужной форели, атлантической миксины (Myxine glutinosa), катрановых акул и канального сома. Инъекции также приводили к ацидозу, вызванного отщеплением H+ от катионов аммония при образовании NH3 [16].
Стоит отметить, что у морских рыб происходит пассивная диффузия как неионизированной, так и ионизированной форм аммония, поэтому проблема токсичности стоит для них особенно остро.
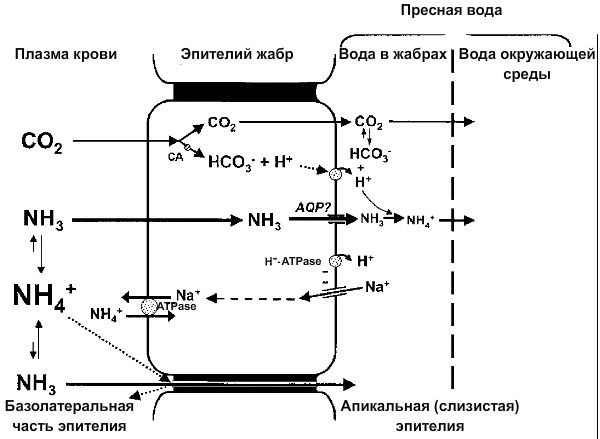
Схема выделения аммиака пресноводными рыбами. AQP — аквапорины (дискуссионный вопрос) [19].
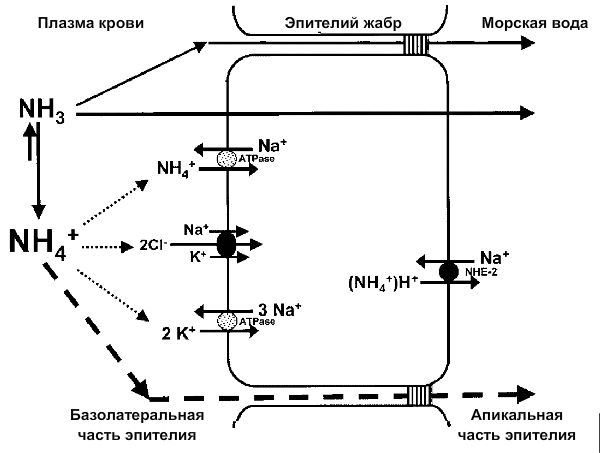
Схема выделения аммиака и аммония морскими рыбами [19].
Отравление водных животных, в частности, рыб аммиаком происходит эндогенным и экзогенным путями. В первом случае, основная опасность для рыб возникает в условиях повышенных значений pH, когда в среде наблюдается сдвиг равновесия в сторону образования неионизированного NH3. Снижается градиент, образующийся в организме аммиак не может диффундировать в среду и начинает накапливаться в виде катионов аммония [17]. Возникает серьезная проблема, связанная со способностью катионов аммония подменять ионы K+ в ионном транспорте и, таким образом, разрушать электрохимимческий градиент в центральной нервной системе и других органах и системах органов.
Влияние экзогенного аммиака/аммония не менее разрушительно. Являясь органом дыхания и осморегуляции, жабры рыб имеют способность к продукции активных форм кислорода. По сообщениям Ching et al. (2009), 12-48-и часовое выдерживание илистого прыгуна B. boddarti, обладающего высокой сопротивляемостью к токсическому эффекту аммиака/аммония, в среде с 8 нмоль/л NH4Cl (pH 7.0) приводит к окислительному стрессу в жабрах и головном мозге. Жабры рыбок подверглись стрессу после 12 часов, что сопровождалось возрастанием концентрации перекиси водорода в липидном слое мембраны, снижением концентрации восстановленного мономерного глутатиона, активности глутатионпероксидазы, глутатионредуктазы и каталазы [18].
Глутатионпероксидазы — семейство ферментов, защищающих организм от окислительного повреждения. Глутатионпероксидазы катализируют восстановление перекисей липидов в соответствующие спирты и восстановление пероксида водорода до воды.
Деструктивные изменения в живых тканях, в том числе и жабрах под действием аммонийного раствора, объясняются, главным образом, их перекисным окислением. Другим немаловажным аспектом токсического влияния NH3 и NH4+ является нарушение ионного транспорта, не связанного с накоплением эндогенного аммония. В частности, содержание радужной форели (O. mykiss) и золотой рыбки Carassius auratus в аммонийном растворе приводило к ингибированию входящего Na+-тока. Данный эффект специфичен только для захвата натрия. Интересно, что снижение тока наблюдается при относительно высокой концентрации NH3 (28.2 мкмоль/л при общем содержании аммония 5.2 ммоль/л), тогда как концентрации до 6,4 мкмоль/л (при общем содержании аммония 1.2 ммоль/л), напротив, стимулирует его [17].
Токсичность аммиака для растений
Аммиак снижает ростовые показатели растений, а также может погубить их. Водные растения обладают различной восприимчивостью к содержанию NH3, даже в рамках одного рода. Например, Elodea canadensis при содержании в течение 7 дней в воде с pH -8,4 и 3,2 мг/л NH4+ демонстрирует незначительное снижение фотосинтеза (на 20%), в то время как Elodea nuttalli и E. ernstae в условиях с 9,6 мг/л NH4+ либо вообще не реагируют, либо повышают фотосинтетическую активность [5; 6].
В среде с pH 8,4 примерно 15% аммония переходит в аммиак [7].
Другие исследования, проведенные на Potamogeton densus и Stratiotes aloides, показано, что развитие первого подавляется в присутствии 5 мг/л NH4+, а второй гниет и разрушается в течение 10 дневного выдерживания в воде с содержанием 0,9 мг/л NH4+. Высокие концентрации (2,6-26 мг/л NH4+) не ингибируют Salvinia molesta и, в некоторой степени, даже стимулируют её рост [8].
Таким образом, опасная доза аммиака для восприимчивых видов растений достигается в присутствии 1 мг/л NH4+. Однако менее чувствительные экземпляры, в особенности, приспособленные к жизни в богатой органической нагрузкой среде, остаются интактными даже в условиях с 26 мг/л катионов аммония.
Растения быстро обезвреживают аммиак, который, сам по себе, медленно пассивно проникает через мембрану клетки, но может соединяться с H+ и в составе катиона накапливаться в вакуолях путем активного транспорта. Так, вакуоли Nitella clavata содержит свыше 2400 мг/л NH4+. Вообще многие молекулы, до момента получения ими дополнительного заряда, не подвергаются захвату, например, CO2, NH3, HNO2 и H2S, что отчасти объясняет их токсичность [9; 10].
Другим способом детоксикации является использование аммиака непосредственно для синтеза белков. В процессе сборки аминокислот токсичный NH3 соединяется с углеводами. Это приводит к обеспечению пластического обмена необходимыми аминокислотами и, соответственно, более быстрому росту растений.
Если у растения имеется выбор между потреблением катионов аммония или нитратов в качестве источника азота, он будет захватывать исключительно аммоний. Лишь при отсутствии последнего начнется впитывание нитратов.
——
1. Timmons, M.B., Ebeling, J.M., Wheaton, F.W., Summerfelt, S.T. and Vinci, B.J. 2002. Recirculating Aquaculture Systems, 2nd Edition. Cayuga Aqua Ventures, Ithaca, NY 14850, USA. 800 p. NRAC Publication No. 01-002
2. Emerson K., Russo R.C., Lund R.E., Thurston R.V. Aqueous ammonia equilibrium calculations: effect of pH and temperature. Journal of the Fisheries Research Board of Canada. 32 : 2379-2383. 1975
3. Summerfelt, S.T. and Sharrer M.J. 2004. Design implication of carbon dioxide production within biofilters contained in recirculating salmonid culture systems. Aquacultural Engineering 32: 171 – 182
4. Mercedes Isla Molleda. Water quality in recirculating aquaculture systems (ras) for arctic charr ( salvelinus alpinus L.) culture. División de Cultivos Marinos, Centro de Investigaciones Pesqueras (CIP)
5. Bennett A.C. Toxic effects of aqueous ammonia copper zinc lead boron and manganese on root growth. In: Carson EW (ed) The plant root and its environment, pp 669–683. 1974
6. Dendène M.A., Rolland T., Trémolières M., Carbiener R. Effect of ammonium ions on the net photosynthesis of three species of Elodea. Aquatic Botany. 46 (3–4) : 301–315. 1993
7. Durborow R.M., Crosby D.M., Brunson M.W. Ammonia in Fish Ponds. SRAC Publication No. 463
8. Cary P.R., Weerts P.G.J. Growth of Salvinia molesta as affected by water temperature and nutrition II. Effects of phosphorus level. Aquatic Botanyю 17 (1) : 61–70. 1983
9. Taylor R.B, Peek J.T.A, Rees T.A.V. Scaling of ammonium uptake by seaweeds to surface area:volume ratio : geographical variation and the role of uptake by passive diffusion. Marine Ecology Progress Series. 169 : 143-148. 1998
10. Kleiner D. The transport of NH3 and NH4+ across biological membranes. Biochim Biophys Acta. 639 (1) : 41-52. 1981
11. Meade, J.W., 1985. Allowable ammonia for fish culture. Prog. Fish Cult., 47: 135-145; Kirk, R.S. and J.W. Lewis, 1993. An evaluation of pollutant induced changes in the gills of rainbow trout using scanning electron microscopy. Environ. Technol., 14: 577-585
12. Salin, D. and P. Williot, 1991. Acute Toxicity of Ammonia to Siberian Sturgeon (Acipenser baeri). In: Acipenser, Williot, P. (Ed.). Cemagref Publication, France, pp: 153-167
13. A. Chezhian, D. Senthamilselvan and N. Kabilan, 2012. Histological Changes Induced by Ammonia and pH on the Gills of Fresh Water Fish Cyprinus carpio var. communis (Linnaeus). Asian Journal of Animal and Veterinary Advances, 7: 588-596
14. Evans D.H, More K.J, and Robbins S.L. Modes of ammonia transport across the gill epithelium of the marine teleost fish, Opsanus beta. J Exp Biol 144: 339–356, 1989
15. Wright P.A. Nitrogen excretion: three end products, many physiological roles. The Journal of Experimental Biology 273 (198) : 273–281. 1995
16. Evans D.H., Piermarini P.M., Choe K.P. The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste. Physiol Rev. 2005. 85(1) : 97-177
17. Ip Y. K., Chew S. F. and Randall, D. J. (2001). Ammonia toxicity, tolerance and excretion. in Fish Physiology, Vol. 19, Nitrogen Excretion, eds P. A. Wright and P. M. Anderson (New York: Academic Press), 109–148
18. Ching B., Chew S.F., Wong W.P., Ip Y.K. Environmental ammonia exposure induces oxidative stress in gills and brain of Boleophthalmus boddarti (mudskipper). Aquat Toxicol. 95 (3): 203-12. 2009
19. Wilkie M.P. Ammonia excretion and urea handling by fish gills: present understanding and future research challenges. J Exp Zool. 2002. 293 (3) : 284-301.
Похожие статьи: