Фундаментальным вопросом при изучении общения живых существ является вопрос о времени и месте испускания сигналов. Тогда как некоторые из них, такие как фенотипические особенности (окраска, форма плавников), представлены постоянно, другие, например, пение, призывные крики и двигательные демонстрации посылаются в нужный момент в направлении предполагаемого приемника.
Различные типы сигнализации имеют разную цену, которая определяется риском привлечь конкурента или, ещё хуже, хищника [1], поэтому отбор направлен на развитие тактических методов привлечения (временные). То есть попытки передачи информации будут наблюдаться только в присутствии принимающего животного («работа на зрителя») [2].
В частности, высокий комплекс социальной организации муравьев обусловлен сложной пространственной и временной моделью выделения феромонов [3]. У саламандр высвобождение мужских половых феромонов в совокупности с двигательными демонстрациями самца привлекают самок [4]. Среди водных животных самцы ракообразных выделяют мочу навстречу противнику во время боя [5, 6].
Химическая коммуникация также широко распространена у рыбок [7]. В то время как химические сигналы часто связывают с активностью запаховых желез [9, 10], у рыбок они сложно определимы. Тем не менее, феромоны, содержащиеся в моче рыбок, могут нести сигнальную функцию даже в отсутствии специальных морфологических структур и визуально наблюдаемого поведения. У золотой рыбки (Carassius auratus) стероидные соединения, выделяемые с мочей, являются сигналом повышения половой активности самок, мочеиспускание которых возрастает в присутствии самцов [11]. У мозамбикской тиляпии (Oreochromis mossambicus) феромоны мочи являются индикатором социального доминирования [12], самцы усиленно выделяют мочу в присутствии привлекательных самок [13].
Обмен информацией за счет химических сигналов у рыбок играет существенную роль в выборе полового партнера схожего вида. Тем не менее, предполагается, что большинство рыбьих феромонов пассивно выделяются в среду, потому что у них нет специальных запаховых желез и поведения, направленного на оставление меток.
В исследованиях, проведенных на особях вида Xiphophorus birchmanni, была продемонстрирована сложная система управления выделением феромонов, подобная системе территориальных животных. Вещества выделялись в особом временном и пространственном контексте для более эффективной передачи сигналов.
Меченосцы являются прекрасной моделью изучения коммуникации животных. С представителями рода Xiphophorus выполнено множество работ, посвященных роли химических сигналов самца в видовой избирательности [14-19]. Сигналы эволюционно лабильны, и филогенетически более дифференцированные из них более привлекательны для самок [17, 20]. За единичным исключением [20], самки предпочитают запах конспецифичного партнера, чем гетероспецифичного, не смотря на то, что последний может выглядеть более красочным [14, 21]. Соответственно, химические релизеры играют ключевую роль в репродуктивной изоляции симпатрических меченосцев [22, 23].
Механизм высвобождения феромона с мочей позволяет самцам выбирать время и место сигнализации. Самцы X. birchmanni, подобно самкам золотой рыбки и самцам тиляпии мочатся отдельными промежутками длительностью до 5 секунд. Мочеиспускание происходит не пассивно, а порциями в присутствии других особей. Данный феномен может объясняться физиологической ценой, которую рыбка затрачивает на продукцию феромона, значительной потерей воды, а также опасностью быть съеденным хищником при постоянной сигнализации.
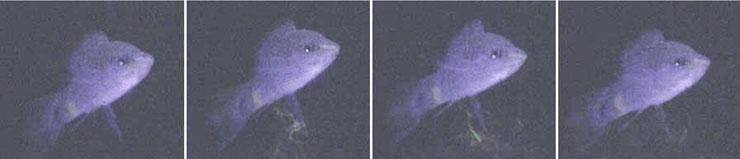
Инъецированный флюоресцеином самец меченосца мочится при ультрафиолетовом
свете (www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0016994)
Помимо того, что самцы меченосцев запасают мочу для более тесного взаимодействия с самками, они приспосабливаются к условиям окружающей среды для лучшего распространения запаха. Известно, что как в воздухе, так и в воде течение играет ключевую роль в переносе химической информации. В природе меченосцы обитают в мелководных каменистых ручьях с умеренным течением. Распространение запаха будет происходить лучше, если самец расположиться вверх по течению по отношению к самкам [22, 24]. Этим и пользуются самцы, проводя большую часть своего времени в верховье и, тем самым, обеспечивая надежный приток феромонов к самкам.
——
оригинал: https://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0016994
1. Zuk M, Kolluru GR (1998) Exploitation of sexual signals by predators and parasitoids. Quarterly Review of Biology 73: 415–438.
2. Marler P, Karakashian S, Gyger M (1991) Do animals have the option of withholding signals when communication is inappropriate? The audience affect. In: Ristau C, editor. Cognitive Ethology: The Minds of Other Animals Essays in Honor of Donald L Griffin. Hillsdale, NJ: L. Erlbaum. pp. 187–208.
3. Hölldobler B, Wilson EO (1990) The Ants. Cambridge, Massachusetts: Belknap Press.
4. Rollman SM, Houck LD, Feldhoff RC (1999) Proteinacious pheromone affecting female receptivity in a terrestrial salamander. Science 285: 1907–1909.
5. Bergman DA, Martin AL, Moore PA (2005) Control of information flow through the influence of mechanical and chemical signals during agonistic encounters by the crayfish, Orconectes rusticus. Animal Behaviour 70: 485–496.
6. Breithaupt T, Atema J (2000) The timing of chemical signaling with urine in dominance fights of male lobsters (Homarus americanus). Behavioral Ecology and Sociobiology 49: 67–78.
7. Stacey NE, Sorensen PW (2005) Hormones, pheromones, and reproductive behaviors. In: Sloman KA, Balshine S, Wilson RW, editors. Behaviour: Interactions with Fish Physiology. New York: Academic Press.
8. Barata EN, Serrano RM, Miranda A, Nogueira R, Hubbard PC, et al. (2008) Putative pheromones from the anal glands of male blennies attract females and enhance male reproductive success. Animal Behaviour 75: 379–389.
10. Rosenthal GG, Lobel P (2006) Communication. In: Sloman K, Balshine S, Wilson R, editors. Behaviour and Physiology of Fish: Academic Press. pp. 39–78.
11. Appelt CW, Sorensen PW (2007) Female goldfish signal spawning readiness by altering when and where they release a urinary pheromone. Animal Behaviour 74: 1329–1338.
12. Barata EN, Hubbard PC, Almeida OG, Miranda A, Canario AVM (2007) Male urine signals social rank in the Mozambique tilapia (Oreochromis mossambicus). BMC Biology 5: 54.
13. Barata EN, Fine JM, Hubbard PC, Almeida OG, Frade P, et al. (2008) A sterol-like odorant in the urine of Mozambique tilapia males likely signals social dominance to females. Journal of Chemical Ecology 34: 438–449.
14. Crapon de Caprona M, Ryan MJ (1990) Conspecific mate recognition in swordtails, Xiphophorus nigrensis and X. pygmaeus: olfactory and visual cues. Animal Behaviour 39: 290–296.
15. Fisher HS, Wong BBM, Rosenthal GG (2006) Alteration of the chemical environment disrupts communication in a freshwater fish. Proceedings of the Royal Society B — Biological Sciences 273: 1187–1193.
16. McLennan D, Ryan MJ (1997) Responses to conspecific and heterospecific olfactory cues in the swordtail Xiphophorus cortezi. Animal Behaviour 54: 1077–1078.
17. McLennan DA, Ryan MJ (1999) Interspecific recognition and discrimination based upon olfactory cues in northern swordtails. Evolution 53: 880–888.
18. Wong BBM, Fisher HS, Rosenthal GG (2005) Species recognition by male swordtails via chemical cues. Behavioral Ecology 16: 818–822.
19. Fisher HS, Mascuch S, Rosenthal GG (2009) Multivariate male traits misalign with multivariate female preferences in the swordtail fish, Xiphophorus birchmanni. Animal Behaviour 78: 265–269.
20. McLennan DA, Ryan MJ (2008) Female swordtails, Xiphophorus continens, prefer the scent of heterospecific males. Animal Behaviour 75: 1731–1737.
21.
Hankison SJ, Morris MR (2001) Sexual selection and species recognition in the pygmy swordtail, Xiphophorus pygmaeus: conflicting preferences. Behavioral Ecology and Sociobiology 51: 140–145.
22. Rosenthal GG, de la Rosa Reyna XF, Kazianis S, Stephens MJ, Morizot DC, et al. (2003) Dissolution of sexual signal complexes in a hybrid zone between the swordtails Xiphophorus birchmanni and Xiphophorus malinche (Poeciliidae). Copeia 2003: 299–307.
23. Culumber ZW, Fisher HS, Tobler M, Mateos M, Sorenson MD, et al. Replicated hybrid zones of Xiphophorus swordtails along an elevational gradient. Molecular Ecology.
24. Ryan MJ, Rosenthal GG (2001) Variation and selection in swordtails. In: Dugatkin LA, editor. Model Systems in Behavioral Ecology. Princeton, New Jersey: Princeton University Press. pp. 133–148.
Похожие статьи:
Меченосец Монтесумы
Поляризованный орнамент меченосцев
Искусственное оплодотворение лирохвостого меченосца
Зеленый меченосец
Сортировка и отлов меченосцев на продажу. 3 часть