
Позвоночные демонстрируют широкий спектр реакций во время родительской заботы, включая охрану потомства перед и после перехода мальков к самостоятельному питанию, а также прямое обеспечение кормом на ранних стадиях развития мальков. Амазонская цихлида Symphysodon spp. (дискус) отличаются от других видов рыб тем, что родители дают малькам слизистый секрет. Данная активная форма заботы, которая продолжается около месяца, предъявляет физиологические требования к родителям и может привести к возникновению конфликта между родителями и отпрысками. В данной статье рассказано о взаимоотношениях родителей и потомства в течение цикла размножения, раскрывается состав эпителиальной слизи (общий белок, кортизол, иммуноглобулины, концентрация ионов Na+, K+ и Ca2+), а также поведенческая динамика взаимоотношений родитель-потомок. На протяжении всего цикла воспроизводства отмечалось возрастание кормления мальков слизью и соответствующее возрастание частоты возвращения самцов и самок к малькам. Пик производства антител слизи отмечался, когда мальки переходили к свободному плаванию, что свидетельствует о роли слизи, аналогичной молозиво у млекопитающих. Белковая составляющая слизи уменьшалась в течение второй и третей недели свободного плавания, и «отнятие от груди», подобное тому, что наблюдается у млекопитающих, происходило в конце 3 недели. Во многих отношениях родительское поведение дискусов более схоже с поведением млекопитающих или птиц, чем других видов рыб, что представлено на стимулирующей аквариумной модели изучения конфликта родитель-потомок.
Снизу представлен полный перевод статьи Jonathan Buckley, Richard J. Maunder, Andrew Foey, Janet Pearce, Adalberto L. Val and Katherine A. Sloman «Biparental mucus feeding: a unique example of parental care in an Amazonian cichlid» // The Journal of Experimental Biology, №213, 3787-3795 pp, 2010
Работа будет интересна аквариумистам, которые занимаются содержанием и разведением дискусов. Хотя текст сложен для восприятия, он изобилует фактическими данными, касающимися физиологических и поведенческих особенностей полового поведения дискусов.
Оригинал представлен в свободном доступе — jeb.biologists.org/content/213/22/3787.full.pdf
Кормление слизью потомства: уникальный пример родительской заботы амазонских цихлид
Главы введение, обсуждение и заключение вынесены на первый план.
Введение
Неонатальный период является наиболее важным этапом любого живого организма, вследствие повышенной восприимчивости к широкому диапазону биотических и абиотических факторов, таких как заболевания, хищничество и возмущения окружающей среды. Для смягчения этапа повышенной восприимчивости и возрастания выживаемости потомства у многих видов выработались стратегии родительской заботы (Clutton-Brock, 1991). Данные стратегии охватывают полный спектр поведенческих реакций, от простейшей защиты потомства, которая наблюдается у многих видов рыб, до кормления родителями своих мальков в течение первой фазы постэмбрионального развития. Последнее, в основном обнаруживается у птиц и млекопитающих. У млекопитающих, потомство питается молоком, смесью, содержащей много питательных и непитательных факторов, которые очень важны для выживаемости новорожденного (Clutton-Brock, 1991; Klobasa et al., 1987). В первую очередь выделяется молозиво, богатое иммунологическими факторами, такими как цитокины, ростовые факторы, гормоны и иммуноглобулины (LeJan, 1996), которые обеспечивают потомство пассивными формами иммунитета (Goldman et al., 1998). Новорожденные свиньи, лишенные молозиво, демонстрировали 100% смертность (Kurse, 1983), что подчеркивает важность родительского обеспечения. Позднее молоко восполняет недостаток большого количества иммунных факторов, обнаруженных в молозивом, благодаря которым у мальков развиваются собственные иммунные ответы. Молоко является источником жиров и лактозы для развития потомства (Klobasa et al., 1987). Изменение состава материнского молока отражает потребности новорожденного, что и является реципрокной связью самки и отпрыска. Хотя у млекопитающих данное поведение более детализировано, оно также проявляется у других видов, например, у червяг Boulengerula taitanus. У данного организма кормление обеспечивается за счет видоизмененного слоя материнской кожи, который потребляют новорожденные (Kupfer et al., 2006).
Кормление мальков родителями, в конечном счете, приводит к возникновению конфликта родитель-потомок. Данный эволюционный конфликт исходит из различий оптимальной приспособленности родителей и их потомства (Trivers, 1974). Родители стремятся максимизировать свою совокупную приспособленность, кормя своих отпрысков, но лишь до момента, когда это предполагает сокращающийся доход. Любые родительские вложения до данной точки используют энергию, которая возвратиться в большей степени, если вкладывать её в будущее поколение. Кроме того, это предполагает регуляцию количества корма, которым родитель обеспечивает отпрыска так, чтобы максимизировать свою собственную приспособляемость. Тем не менее, потомство настроено на максимизацию своей собственной приспособляемости и требуют значительно больше заботы от родителей, чем те могут дать. Данный период несоответствия вызывает конфликт родитель-потомок, пик которого у многих млекопитающих часто совпадает со временем отнятия от груди (Clutton-Brock, 1991; Weary et al., 2008). Конфликт наблюдается у ряду видов млекопитающих и птиц, у которых потомство может выполнять несколько поведенческих тактик, например, «плач» или «симулировать истощение», что поддерживает период родительской заботы (DeVore, 1963; Mathevon и Charrier, 2004; Trivers, 1972). Предполагается, что конфликт родитель-потомок начинается ещё в период внутриутробного развития, где плод воздействует на мать с помощью гормональной связи. Сигналы о желаниях поступают от плода, а ответы от материнского организма (Haig, 1993). У лецитотрофных видов, например, большинства костных рыб, у которых не наблюдается внутриматочного взаимодействия, конфликт родитель-потомок развивается в случае, если питание мальков зависит от родителей. Множество видов костных рыб не проявляют родительской заботы (Gross and Sargent, 1985) и поэтому у них сильно сужены рамки конфликта. Исключением является родительская забота различных видов цихлид, поведение которых включает защиту мальков; по крайне мере 30 видов цихлид также выделяют слизь для кормления подрастающего поколения (Noakes, 1979; Hildemann, 1959). Подобная пищевая и поведенческая особенность поддерживает контакт родителей и потомства на протяжении нескольких недель после выклева и, тем самым, способствует развитию конфликта родитель-потомок.
Кормление слизью поддерживает быстрые темпы развития и высокий уровень выживаемости отпрысков, но одновременно исключает возможность осуществления очередного нереста (Chong et al., 2005). Хотя несколько видов цихлид используют данный способ поддержания мальков, лишь у дискусов (Symphysodon) он является обязательным для выживания потомства (Chong et al., 2005). Попытки аквариумистов раньше времени отнять от родителей выводок приводит к высокой смертности последних потому, что они не могут питаться традиционной живой пищей (Hildemann, 1959; Noakes, 1979). Данное обстоятельство показывает значимость родительской слизи для выживаемости мальков и свидетельствует о том, что в ней содержаться важные питательные факторы. Ранние исследования Symphysodon spp. подчеркивали присутствие ряда аминокислот в эпидермальной слизи, демонстрируя её пищевую ценность для мальков (Chong et al., 2005). Докладывалось, что в слизи нескольких видов рыбок присутствуют антитела, такие как иммуноглобулин M (IgM) (Ingram, 1980; Hatten et al., 2001; Shephard, 1994), которые играют роль в защите от бактерий, паразитов и грибов, присутствующих у взрослых особей (Ingram, 1980). Ранние работы также наводят на мысль о возможности переноса антител после икрометания у тиляпий Oreochromis aureus (Sin et al., 1994). Контрольные пробы, произведенные у данного вида, показали вертикально распределение антител в яичном желтке (Sin et al., 1994). Выживаемость потомства, однако, также возрастает в случае, когда самка носит выводок во рту. Хотя это не было продемонстрировано, предполагается, что повышение выживаемости связано с питанием мальков эпидермальной слизью ротовой полости, которая потенциально является источником питательных веществ и антител. По крайней мере, у дискусов IgM переносится малькам при кормлении слизью, что обеспечивает их пассивной формой иммунитета.
Вместе с IgM, вероятно, переносятся гормоны. У цитроновой цихлазомы (Amphilophus citrinellus или Cichlasoma citrinellum) родительская слизь обеспечивает потомство несколькими гормонами, включая соматотропин (гормон роста), тиреоидный гормон и пролактин (Schutz and Barlow, 1997). Данные гормоны выполняют множество функций и особенно важны для развития и роста мальков (Schutz and Barlow, 1997; Takagi et al., 1994). Тесная эволюционная взаимосвязь лимонной цихлазомы и дискусов говорят о том, что у последнего также присутствуюьт озвученные вещества. Могут присутствовать и другие гормоны, например, кортизол (Simontacchi et al., 2008) и андороген 11-кетотестотерон (Schultz et al., 2005), обнаруженные в эпидермальной слизирыбок на уровне, коррелирующим с их концентрацией в плазме.
Пищевое поведение потомства приводит к повреждению эпидермиса родителей, которые испытывают стресс, что приводит к переносу кортизола отпрыскам. Кортизол, известный как стрессорный гормон, поддерживает ионный состав у нескольких видов костных рыб (McCormick, 2000). Обеспечение кортизолом мальков дискусов может являться преимуществом, которое позволяет отвечать на запросы ионной осморегуляции в грязной реке Амазонка. Кроме того, эпидермальная слизь является источником ионов. Пресноводные рыбки постоянно теряют ионы, которые пассивно выходят в окружающую среду, а восполняют недостаток через жабры и корм (Smith et al., 1989). Экспериментальный рацион питания богатый ионами, помогал удовлетворять требованиям осморегуляции пресноводных рыбок, позволяя энергии нормально использоваться в осморегуляции для поддержания роста (Gatlin et al., 1992). Слизистые слои пресноводных костных рыб помогают снизить потерю ионов через поверхность тела (Shephard, 1994), образуя барьер в виде градиента для диффузии (Shephard, 1994). Слизь взрослых дискусов может, кроме того, содержать значительное количество ионов, которое подпитывает потомство, но обычно отсутствуют в окружающей среде. Особенно это наблюдается при повторяющихся укусах мальков, что приводит к потере ионов в эпидермисе родителей.
В отличие от млекопитающих, у которых за кормление мальков отвечает только самка, у дискусов участвуют оба производителя (Chong et al., 2005; Hildemann, 1959). Обязанности по вскармливанию ложатся на обоих родителей, но как это сказывается на конфликте родитель-потомок неизвестно. Вероятно пик конфликта, как у млекопитающих, наблюдается перед тем как родительская забота медленно убывает с развитием мальков (Clutton-Brock, 1991). Разводчики дискусов долгое время обнаруживают, что особи, которые обеспечивали слизью потомство более одной недели, имеют меньше потомства в будущем (Chong et al., 2005). Это свидетельствует о том, что наблюдаются значительные издержки, относящиеся к родительской заботе у данного вида, и имеются пределы для развития конфликта родитель-потомок.
Вскармливание слизью потомства у дискусов является необычной стратегией у рыб, во многом подобной другим формам заботы у других позвоночных. Целью работы являлось изучение динамики взаимодействия «родитель-потомок» у дискусов. В начале для понимания физиологической значимости эпидермальной слизи и рассмотрения гипотез о существовании в ней необходимых питательных и других факторов, анализировался состав слизи за весь период родительской заботы. Для определения того, оказывает ли влияние инбридинг на состав слизи, произведены её сравнения у лабораторных и диких амазонских дискусов. Наконец, для рассмотрения гипотезы о проявлении конфликта родитель-потомок и динамики изменений взаимодействия взрослых особей и отпрысков, исследователи наблюдали поведение родителей и мальков в течение 4 недель, когда потомство питалось слизью.
Обсуждение
Проявление родительской заботы
Первые две недели родительская опека дискусов заключалась в вовлечении обоих производителей, один из которых, либо оба присматривают за мальками. В течение 1 недели потомство значительно больше времени проводит на самке, чем на самце. Однако это наблюдалось только для одной самки, которая в первую неделю препятствовала приближению самца к малькам. Тем не менее, она смягчила свое отношение ко второй недели, когда самец разделил родительские обязанности. На протяжении первых двух недель частота, с которой родители обменивались обязанностями, то есть такие модели как только самец осуществляет опеку, только самка, оба родителя с мальками или мальки одни – была относительно низкой, взрослые особи часто наблюдали за молодью в течение 5-10 минут, позволяя последним кормиться на охраняемой области. Когда происходило переключение модели заботы, родитель резко изгибал тело, переводя молодь на своего партнера. Подобное поведение взрослых особей отражалось на поведении мальков, которые неуклонно повышали интенсивность укусов. Тоже обнаружено у Хонга (Chong et al., 2005).
Поведение родителей начало меняться на 3 неделе, когда на короткое время они оставляли потомство, и тем самым затрудняли доступ к слизи. Средняя продолжительность опеки каждого родителя снизилась на 3 неделе (30-60 секунд) по сравнению с первой (5-10 минут), мальки провоцировались на постоянное движение за родителями и собственный поиск корма. Отпрыски не могли долго обмениваться между производителями при покачивании телом; на самом деле, родители активно уплывали от потомства, оставляя их одних. Это привело к тому, что мальки начали активно искать своих родителей, что наблюдалось на 3 неделе, а также проявляли пищевое поведение. Остается неясным, вызваны подобные изменения пищевой стратегии следствием избегания производителями, либо другими базовыми изменениями развития мальков. Вероятно, молодь также развивала оборонительное поведение против хищников, что вызвано оставлением их одних (Brown, 1984). Интенсивность укусов достигала максимума на 2 неделе, а затем падала на 3, что свидетельствует об изменении родительского поведения, которое влияло на возможность питания мальков.
Четвертая неделя показала дальнейшее возрастание времени независимого плавания мальков, в то время как производители, демонстрируя очевидные повреждения эпидермиса, стремились уплыть подальше. У взрослых особей на 4 неделе отмечалось эпидермальное повреждение и стресс, в совокупности с недостатком кормовых частиц в аквариуме для молоди. На данном этапе были добавлены науплии артемий. Присутствие артемии, как известно, снижает интенсивность укусов (Chong et al., 2005), однако они вводились в момент, когда производители уже избегали молодь. Кормление артемией обеспечило дискусов планктоноядной пищей, которая доступна в естественных условиях обитания. Хотя молодь все ещё пыталась кормиться слизью, постоянные перемещения взрослых дискусов определило большую выгоду от кормления науплиями. Данное поведение привело к снижению заботы родителей, и на 4 неделе молодь была оставлена.
Изменения поведения производителей от пристального внимания за потомством на 1-2 неделях до модели поведения 3-4 недель, когда взрослые особи препятствуют кормлению мальков, демонстрируют конфликт и схоже с периодом «отнятия от груди» у птиц и млекопитающих (Weary et al., 2008). С ростом и развитием молоди, ей необходимо больше ресурсов. Цена для родителей, обеспечивающих корм, возрастает до момента, когда они и молодь вступают в конфликт (Trivers, 1974). Родители других позвоночных изменяют свое поведение для увеличения цены домогательства молоди, целью чего является развитие независимого пищевого поведения (Davies, 1978; Pugesek, 1990; Rehling and Trillmich, 2008; Weary et al., 2008). Результаты исследований, проведенных на дискусах, демонстрируют подобную стратегию воспроизводства.
Состав слизи дискусов
В дополнение к наблюдениям за родительским поведением, также исследовался состав слизи. IgM, компонент адаптивной иммунной системы позвоночных, ранее обнаружен в слизи ряда видов рыб (Ingram, 1980; Hatten et al., 2001; Shephard, 1994). В результате настоящего исследования иммуноглобулин обнаружен в слизи как размножающихся, так и неполовозрелых дискусов. Интересно, что уровень IgM возрастал в слизи производителей сразу после нереста, и рост продолжался до этапа W4. Это говорит о том, что процесс контролируется скорее эндогенно, чем только через восполнения утечки IgM вследствие укусов и эпидермальных повреждений. Механизма, который отвечает за снижение уровня иммуноглобулина на стадии W4, эндогенно управляется схожим комплексом гормонов, инициирующих изменение родительского поведения на этапе W3, хотя свой вклад могут вносить и укусы мальков. Продукция IgM в слизи происходит пассивно, подобно обеспечению пассивного иммунитета во время лактации у млекопитающих, когда детеныш вплоть до появления собственного адаптивного иммунитета получает антитела матери (Adamski and Demmer, 2000; Klobasa et al., 1987). Не смотря на то, что неизвестно время развития функциональной адаптивной иммунной системы у мальков дискусов, прекращение кормления на этапе W4 может свидетельствовать о его возникновении. Это согласуется с работами, проведенными на других видах рыб, например, Danio rerio, у которых развитие иммунитета продолжается 4-6 недель (Lam et al., 2004). О составе родительской слизи также докладывал Хонг, который обнаружил лектин у нерестящихся дискусов, но не у особей, не вступивших в нерест (Chong et al., 2005). Лектины отвественны за активацию системы комплемента после идентификации патогенных микроорганизмов (Russell and Lumsden, 2005). Хотя их функциональное значение в родительской слизи остается неясным, они легко передаются потомству, предоставляя другую форму патогенной резистентности.
Концентрация IgM в слизи диких была выше по сравнению с аквариумными производителями, что указывает на особую важность обеспечения иммунитетом диких особей в их естественной среде обитания. В отличие от контролируемых аквариумных условий, Амазонка содержит широкий спектр патогенов, которые подвергают риску подрастающее поколение рыб. Коллективное обитание, которое наблюдается дискусов в природе (Crampton, 2008), повышает возможность встречи мальков с патогенами (Hughes et al., 2002; Poulin, 1999). Интересно, что концентрация IgM в слизи неполовозрелых диких особей очень схожа с составом слизи аквариумных производителей. Во время взятие образцов диких неполовозрелых дискусов, подавляющее большинство имело шрамы и повреждения эпидермиса; присутствие высокого уровня иммуноглобулина M способствует предотвращению бактериальной инвазии поврежденных участков кожи.
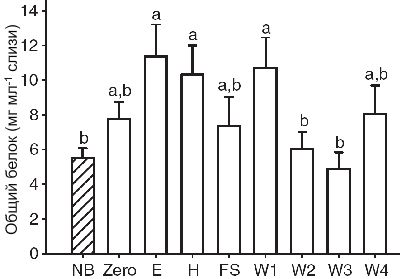
Родительская слизь на этапах W1, E и H имела значимо более высокий уровень общего белка по сравнению с интервалами W2 и W3, что может быть связано с кормлением мальков. Поэтому молодь значительно крупнее и проявляет более высокую интенсивность укусов, чем мальки на этапе W1. Если возрастание пищевого поведения было больше, чем продукция слизи, это привело бы к снижению содержания общего белка. Родительская слизь имела более высокую концентрацию общего белка по сравнению с не размножающимися особями. Возрастание содержания белка, вероятно, связано с увеличением IgM и других факторов, таких как гормоны, аналогичные обнаруженным у цитроновой цихлазомы (Schutz and Barlow, 1997). Механизм, ответственный за возрастание общего белка на этапе икрометания, вероятно, подобен механизму превентивного образования IgM, вовлекающего некоторые типы гормонов. Повышенная концентрация пролактина, гормона, участвующего в увеличении продукции слизи и инициирующего проявление родительской заботы у дискусов (Blum and Fielder, 1965), обнаружен в коже производителей во время ухода за потомством (Khong et al., 2009).
Это может быть один из нескольких гормонов, вовлеченных в в инициирование как поведенческих, так и физиологических ответов, которые проявляются после откладки икринок. Среди всех образцов наиболее низкий уровень общего белка обнаружен у диких неполовозрелых дискусов. Это является результатом давления отбора в естественной и искусственной среде обитания. Нерегулярное поступление пищи (характерно для естественной среды) и необходимость сохранения энергии оказало влияние на продукцию слизи. В аквариуме, где рыбки получают корм до насыщения, неполовозрелые особи могли произвести больше общего белка в слизи.
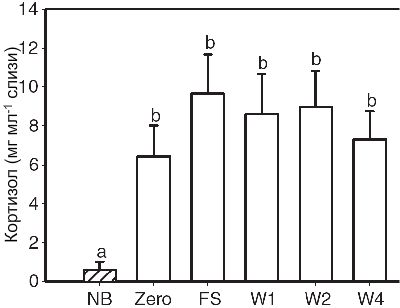
Кортизол присутствовал в слизи аквариумных дискусов, хотя и в меньших концентрациях. В течение цикла воспроизводства не наблюдалось различий в уровне кортизола, он содержался в более высоких концентрациях в слизи производителей, чем неполовозрелых особей. Данный гормон играет витальную роль в ионной регуляции (McCormick, 2000), которая является преимуществом для мальков, выращиваемых в ионно-дефицитной среде. Тем не менее, в противоположность аквариумным рыбкам концентрация кортизола в слизи диких производителей и неполовозрелых особей не обнаруживалась. Поэтому, скорее кортизол является артефактом аквариумной среды или отражает различия в стресс-ответе диких рыбок против инбредной линии, нежели обнаруживается у аквариумных производителей и играет роль в проявлении родительской заботы.
Кроме обеспечения питания, иммунитета и, потенциально, гормонов, родительская слизь помогает малькам выносить суровые условия кислой, ионно-дефицитной среды Амазонки. Одной из главных проблем, связанных с обитанием рыбок в ионно-дефицитной среде, является необходимость регулировать поступление и потерю ионов, таких как Na+, K+ Ca2+ и Cl– для обеспечения осморегуляции. Слизь рыбок, выступая барьером против диффузионной утечки (Shephard, 1994), помогает снижать потери ионов по градиенту (Handy and Maunder, 2009); является вероятным источником ионов для потомства. Концентрация Na+, K+ и Cl– была значимо выше в слизи диких производителей по отношению к диким не размножающимся рыбкам, аквариумным дискусам. Различия в составе ионов в слизи родителей у диких и аквариумных производителей может определяться составом воды в Амазонке и аквариуме. Концентрация ионов в аквариуме (Ca2+ 21.56±1.26мгl–1, Na+ 9.28±0.26мгl–1, K+ 1.42±0.02мгl–1, Cl– 15.32±0.76мгl–1) была выше, чем зарегистрированная в естественной среде обитания (Ca2+ 0.325±0.06мгl–1, Na+ 3.43±1.02мгl–1, K+ 0.46±0.12мгl–1, Cl– 10.05±4.46.мгl–1). Концентрация ионов в аквариумной среде такая, что мальки могут поглотить ионы через жабры и, поэтому, не требуют ионов родительской слизи. И, наоборот, химический состав воды в природе демонстрирует большой недостаток ионов, когда родители обеспечивают ионами молодь.
Заключение
Родительская забота дискусов распределялась равномерно между производителями, поведение которых было направлено на обеспечение потомства IgM, общим белком, ионами и кортизолом посредством эпидермальной слизи. Динамика родительского поведения и физиология слизи в цикле воспроизводства имела некоторые сходства с млекопитающими. Циклическая продукция IgM в слизи достигала максимума к моменту начала свободного плавания мальков и снижалась до исходного (до нереста) уровня, когда молодь начинала питаться другим кормом. Содержание белка в слизи было наименьшим на этапах W2 и W3, что отражает интенсивность питания мальков в этот период. Момент «отлучения от груди» наблюдался на этапе W3, который вероятно инициировался изменением поведения родителей. Исследователи сделали заключение, что репродуктивная стратегия дискусов имела больше сходств с млекопитающими и птицами, чем с другими видами рыб. Это порождает интересный вопрос, касающийся эволюции поведения, а также полового отбора, который предшествует данной форме родительской опеки.
Материалы и методы
Экспериментальное животное и хозяйство
Были куплен выводок взрослых дискусов Symphysodon spp., происходящих от аквариумных особей из Малазии, и помещен в аквариум университета в Плимуте. Рыбки подерглись карантину, очистке от червей (лекарство Discus Wormer; Kusuri, Ньютон Эббот, Великобритания), а затем переведены в 100 литровые аквариумы по 12 особей для наблюдения репродуктивного поведения. Особи, которые формировали пары, помещались в собственный 100-литровый аквариум и нерестились на пластиковый конус. Все рыбки содержались в рециркуляционной системе при постоянных условиях (температура 29 ±0.5°C, pH.7.0±0.5, растворенный кислород 99±0.5%, фотопериод свет/день – 12/12 часов, Ca2+ 21.56±1.26мгl–1, Na+ 9.28±0.26мгl–1, K+ 1.42±0.02мгl–1, Cl– 15.32±0.76мгl–1) и кормились один раз в день фаршем на основе говяжьего сердца или коммерческими гранулами Tetra prima granular; Tetra, Саутгемптон, Великобритания). Вынашиваемые мальки вплоть до конца четвертой недели родительской заботы питались только эпидермальными выделениями, затем в аквариум добавлялись живые науплии артемий.
Наблюдения за поведением
Поведенческие наблюдения производились на первый день свободного плавания мальков и продолжались ежедневно до последнего дня кормления слизью (примерно 35 дней после оплодотворения икры). Ежедневно измерялось два поведенческих параметра, распределение мальков на родителях и их частота укусов. Показатели регистрировались на глаз, по крайней мере, через час после кормления производителей, что предотвращало любые помехи от движения кормящихся взрослых особей. Затемнение при наблюдении не было необходимо, потому что дискусы продолжают проявлять естественную родительскую заботу, когда за ними следят.
Распределение родительской заботы
В данном случае родительская забота определялась только у родителей, которые позволяли малькам питаться их эпидермальной слизью. В течение 1 часа молодь наблюдалась как одна группа, записывался характер её кормления. Наблюдения протоколировались на основе 4 четких состояний: молодь кормится только на самке, молодь кормится только на самце, молодь кормится на обоих родителях, молодь не кормится. Записи выглядели как «самка», «самец», «оба» и «никто», соответственно. Данные включали общее время, затраченное каждым родителем на кормление мальков, а также продолжительность каждого периода кормления.
Интенсивность укусов
Выбранный случайно малек, наблюдался в течение 30 секунд. За это время подсчитывалось количество укусов эпидермиса родителей. Каждый укус заключался в следующем: малек подплывал к взрослой особи, отгрызал слизь, помогая при этом резкими рывками всего тела. Подсчеты повторялись для 10 мальков для каждого родителя, а затем вычислялось среднее значение. Молодь, которая скрывалась с поля зрения в 30-секундном промежутке времени, игнорировалась и наблюдения начинались заново.
Образцы слизи
В лабораторных исследованиях отбор слизи осуществлялся у 6 пар производителей (N=6) в 8 ключевых точках цикла воспроизводства, к которым относятся икрометание (E), уход за икрой (H), свободно плавающее потомство (FS), свободно плавающее потомство + 1 неделя (W1), + 2 недели (W2), + 3 недели (W3) и + 4 недели (W4). Нулевая проба бралась у производителей из другого цикла воспроизводства, у которых за два дня до этого была удалена кладка. Нулевой образец отражает период, когда известно, что родители достигли половой зрелости, но ещё не вступили в нерест. Также анализировались образцы слизи неполовозрелых особей (NB), не образовавших пары. Исследование проходило по методике Шультца и др. (Schultz et al., 2007), где слизь собиралась в предварительно взвешенные полиэстеровые губки (Buff-Puff facial sponge; 3M, St Paul, Миннесота, США), нарезанные на кусочки 2х2х1 см. Рыбку вылавливали из аквариума, используя мелкий сачок, располагали непотревоженным боком кверху и давали в течение 5 секунд обсохнуть, затем проводили губкой, удаляя примерно 30% слизи с одной стороны тела. Предварительно взвешенная губка, содержащая слизь, возвращалась в предварительно взвешенный шприц и взвешивалась с точностью до 0,0001 г для выяснения массы и объема слизи. Шприц выдавливался до тех пор, пока из губки не выходила проба слизи, которая помещалась в 1,5 мл пробирку Эппендорфа; В шприц с губкой добавлялся 1 мл дистиллированной воды, которая затем выдавливалась для растворения и выведения оставшейся слизи. Полученная смесь цинтрифугировалась (13000 г в течение 5 минут), надоосадочая жидкость немедленно замораживалась (-80 0C) для дальнейших исследований. Результат отбора был явно заметен на рыбках, эпидермис которых выглядел более светлым. Нормальная окраска, тем не менее, восстанавливалась за 1 час, что свидетельствует о выделении новой порции слизи. Скорая регенерация в совокупности с еженедельным отбором слизи, свидетельствует о незначительном влиянии процесса отбора на производителей и доступность слизи для молоди.
Дикие особи
Из Риу-Негру, выше по течению от Барселуса (00°42’ 02’’ Ю, 062°54’ 27’’ З), было выловлено 90 неполовозрелых диких особей. Рыбки в течение 8 ночей (с 29 октября по 5 ноября 2007 год) ловились по отдельности местным рыбаком при помощи фонарика и ручной сети. Отбор слизи осуществлялся по методике, описанной выше, однако происходил в полевых условиях, экстрагированные образцы находились во льду до момента, когда они прибыли в лабораторию, где хранились при температуре -20 0C. Особи измерялись при помощи 30 см рулетки и возвращались в воду. В шести местах брались пробы воды для проведения ионного анализа (Ca2+ 0.32±0.06.мгl–1, Na+ 3.43±1.02мгl–1, K+ 0.46±0.12мгl–1, Cl– 10.05±4.46мгl–1). В течение 11-21 февраля 2008 года у размножающихся дискусов были взяты образцы слизи. В исследовании принимали участие 4 пары производителей с потомством. Также наблюдалось десять мальков от каждой пары, которые затем при температуре -20 0C были привезены в Плимут.
Измерения мальков
Каждые 3 суток в одно время с экспериментальными рыбками (от свободно плавающих мальков до 4-недельных) измерялась длина по Смиту молоди не участвующих в эксперименте пар. Также было измерено 6 мальков неизвестного возраста в одно время с парой производителей дикого типа.
Физиологический анализ
IgM
Измерение уровня специфических антител в слизи кормящих производителей производилось при использовании конкурентного твердофазного иммуноферментного анализа (Magnadottir, 1998) для определения общего IgM в рыбе. Образцы крови брались у производителей из сосудов хвоста и оставлялись в виде сгустка на ночь при температуре -4 0C; образцы сыворотки собирались и хранились при температуре -20 0C. Сыворотка очищалась при использовании очистительных колонок HiTrap IgM (GE Healthcare, Amersham, UK). Для оценки концентрации IgM полученные фракции IgM объединялись и считывались при помощи Брэдфорд белка анализа. Очищенный IgM разбавлялся 1:400 в карбонатно-бикарбонатном буфере и в каждую ячейку 96-луночной плоскодонной микроплаты для титрования (Nunc MaxiSorp, Rochester, Нью-Йорк, США) добавляли по 100 мкл раствора. После 18 часов при температуре 4 0C незафиксированный IgM удалялся трех разовым промыванием лунок промывочным солевым буфером (ПСБ) низкой концентрации, pH 7,3, 5% полисорбата 20. Перед трех разовым промыванием в ПСБ непокрытые области блокировались на всю ночь 5% раствором сухого молока, разведенного с фосфатным солевым буфером (ФСБ), при температуре 4 0C Образцы слизи разбавлялись 1:3 в ФСБ, содержащего 0,05% полисорбата 20; затем 100 мкл пробы помещалось в лунку и в течение 2 часов при температуре 37 0C конкурировало с 100 мкл перекрестно-реагирующего моноклонального анти-IgM азиатского морского окуня, разбавленного 1:10 в 1% растворе альбумина бычьей сыворотки. Любые несвязанные анти-IgM комплексы в слизи удалялись пятикратным ополаскиванием микроплаты ПСБ высокой концентрации, pH 7,7, 10% полисорбата 20. Позднее микроплата инкубировалась в течение часа при комнатной температуре с 100 мкл пероксидазного конъюгата против IgM мыши, разбавленного 1:400 в 1% растворе ФСБ и низкоконцентрированного ПСБ. Не прореагировавшие антитела коньюгата удалялись 5-разовым ополаскиванием ПСБ высокой концентрации. Затем в ячейки в объеме 100 мкл добавлялся пероксидазный субстрат тетраметил бензидина (ТМБ), реакция прекращалась с 50 мкл стоп-раствора (1.8.моль–1.H2SO4). После этого считывалась степень абсорбции при помощи биохимического планшета ридера Optimax (спектрофотометр с длиной волны 450 нм; Molecular Devices, Sunnyvale, Калифорния, США). В качестве негативного контроля использовалась слизь форели.
Белки, ионы и кортизол
Образцы слизи размораживались, разбавлялись дистиллированной водой и анализировались по описанной ранее методике. Концентрация общего белка определялась при использовании Брэдфорд белка анализа (Bradford, 1976). Концентрация Na+, K+ и Ca2+ измерялась при помощи плазменной атомно-эмиссионной спектроскопии с индуктивной связью (Varian 725-ES ICP оптико-эмиссионный спектроскоп; Varian, Santa Clara, Калифорния, США). Концентрация хлорида определялась за счет колориметрического анализа по Залу (Zall et al., 1956). Концентрация кортизола в слизи анализировалась в иммуноферментном твердофазном анализе (ELISA) (DRG Diagnostics, Марбург, Германия). Кортизол от стандартных проб и от образцов выделялся при помощи вихревого смешивания с этилацетатом (300 мкл:300 мкл пробы: этилацетат; Fisher Scientific, Питсбург, Пенсильвания, США). Перед проведением анализа отделялось 250 мкл раствора, высушивалось под жидким азотом, после чего смешивалось с ФСБ, содержащим 0,1% адьбумина бычьей сыворотки (Sigma-Aldrich, Dorset, UK).
Статистическая обработка
Полученные данные проверялись на нормальность и гетерогенность при использовании теста Колмогорова-Смирнова и теста Левина, соответственно, и согласовывались с параметрическими допущениями.
Физиология
Физиологические данные подсчитывались как отношение объема слизи к объему общего белка. Содержание общего белка значительно варьирует в цикле воспроизводства (Chong et al., 2005), и, таким образом, не является точным физиологическим показателем. К физиологическим данным относилось два типа сравнения. Сравнение количества слизи между не размножающимися и размножающимися особями (значения объединены во всех точках цикла воспроизводства) рассматривалось с использованием теста one-way ANOVA, следующего за постфактум анализом наименьшей значимой разности (LSD). Сравнения между составом слизи производителей на различных этапах воспроизводства производились с использованием теста repeated measures ANOVA, где в качестве факторов учитывался пол и точка на временном отрезке. Значимые эффекты времени записывались, при этом использовался постфактум paired t-tests. При помощи теста one-way ANOVA каждый измеренный физиологический параметр сравнивался у производителей и неполовозрелых особей из Бразилии и Плимута. Из 90 диких неполовозрелых дискусов использовалось 12 особей в качестве репрезентативной выборки для сравнения количества слизи с дикими производителями (N=8), аквариумными производителями (N=8) и аквариумными не размножающимися дискусами (N=12). Состав слизи диких бразильских пар сравнивался с аквариумными парами из Плимута, которые выращивали мальков уже 3 недели; длина по Смиту мальков от бразильских пар (15±0,8 мм; N=6) была сопоставима с трехнедельными аквариумными мальками (15±0,1 мм; N=6).
Поведение
Тест repeated measures ANOVA использовался для оценки эффектов времени репродуктивного периода на степень укусов, изменений родительской заботы и времени, в течение которого, потомство связано с каждой моделью заботы. В точках, где наблюдались значительные эффекты, использовался paired t-tests. Тест one-way ANOVA (LSD post hoc) применен для оценки недели различий того, как долго мальки связаны с каждой моделью родительской заботы.
Результаты
Время, проведенное на родителях
На 4 недели в сравнении с первыми тремя неделями молодь тратила значительно больше времени на свободное плавание (без взрослых особей) (RM-ANOVA, F1,3=4.99, P<0.05, N=6; Рисунок 1D). Мальки также проводили с самкой меньше времени на 4 недели по сравнению с первыми тремя (RM-ANOVA, F1,3=4.012, P<0.05, N=6; Рисунок 1B). Однако не было обнаружено статистически значимых различий во времени, которое мальки проводили с самцом или с обоими родителями в течение 4 недель (RM-ANOVA, самец, F1,3=1.54, P=0.25; оба производителя, F1,3=0.28, P=0.84; Рисунок 1A,C). Интересно, что в течение первой недели потомство проводило больше времени, питаясь на самке, чем на самце (one-way-ANOVA, F3,23=4.52, P<0.05, N=6).
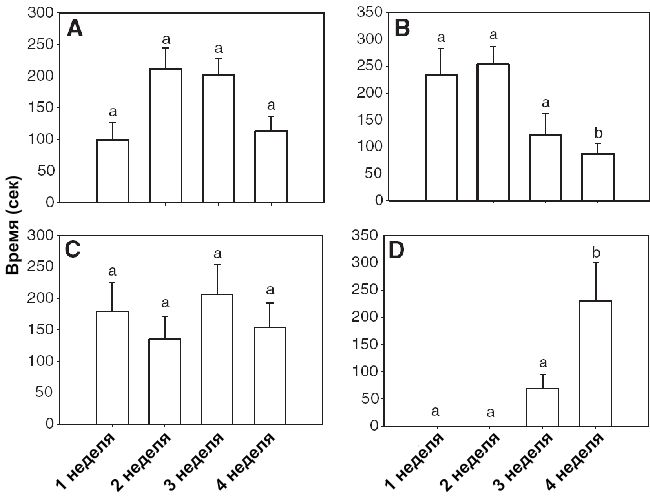
Изменения родительской заботы
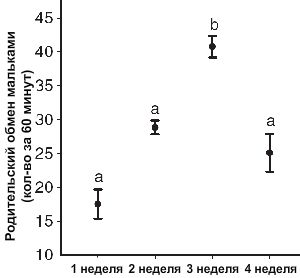
В течение всего цикла воспроизводства производители регулярно меняли степень родительской заботы. Первые 2 недели характеризовались обменом мальками между взрослыми особями, которые покачивали своим телом, перемещая молодь. Однако в течение последних двух недель производители часто уплывали от молоди, оставляя их одних; это провоцировало мальков на перемещение вслед за родителями и активным поиском пропитания. Ряд изменений в степени опеки неуклонно возрастал от момента, когда мальки начали питаться на 1 недели, достигая пика на 3 недели (Рисунок 2). В течение 1,2 и 4 недели наблюдались значимые различия поведения производителей (RM-ANOVA, F1,3=5.677, P<0.05, N=6).
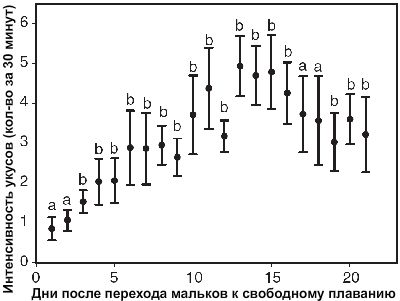
Интенсивность укусов мальков за 30 секунд на обоих родителях за первые три недели. Различными буквами отмечены значимые отличия (paired t-test, P<0.05, N=12); столбцы без букв не показали статистически значимых различий. Данные представлены как среднее ± стандартная ошибка средней.
Интенсивность укусов
Интенсивность укусов возрастала на протяжении всего времени (RM-ANOVA, F1,20=7.933, P<0.05, N=12), достигая пика на 12 до 15 дня, когда происходило плавное снижение (Рисунок 3). Интенсивность укусов молоди на самке и самце, однако, значимо не отличалось (RM-ANOVA, F2,40=0.304, P=1.00)
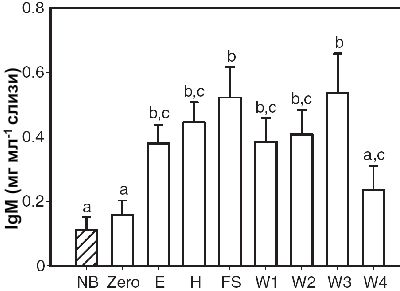
IgM
Слизь, собранная в нулевой этапе, имела значительно меньше иммуноглобулина G (RM-ANOVA, F1,7=3.732, P<0.05, N=12), чем собранная на этапах E, H, FS, W1, W2 и W3 (Рисунок 4). Возрастание выделения IgM в слизи производителей в период размножения сохранялось вплоть до W4, когда отмечалось падение концентрации. На четвертой недели постэмбрионального развития концентрация IgM не отличалась от нулевого этапа. Не обнаружено половых различий в концентрации IgM (RM-ANOVA, F1,7=0.518, P=0.817). Уровень IgM в слизи неполовозрелых особей был значительно ниже по сравнению с производителями на все этапах цикла размножения, за исключением нулевого и W4 (one-way ANOVA, F8,96=3.397, P<0.05, N=12 или 8; Рисунок 4). Дикий тип дискусов из Бразилии демонстрировал значимо более высокий уровень IgM, чем аквариумный и дикий тип неполовозрелых особей, и аквариумных производителей (one-way ANOVA, F3,39=3.219, P<0.05, N=12 или 8; Таблица 1).

n.d. — не определено.
Общий белок
Слизь производителей содержит значимо меньше общего белка на этапах W2 и W3 (RM-ANOVA, F1,7=4.006, P<0.05, N=12), чем на E, H и W1 (Рисунок 5). Слизь неполовозрелых особей имеет значительно меньше общего белка по сравнению с слизь производителей на этапах E, H и W1 (one-way ANOVA, F8,96=2.642, P<0.05, N=12 или 8; Рисунок 5). Не обнаружено половых различий в содержании общего белка у производителей (RM-ANOVA, F1,7=0.763, P=0.620). Сравнения между дикими и аквариумными особями продемонстрировали более низкий уровень общего белка в слизи неполовозрелых диких рыбок в отличие от диких размножающихся, аквариумных размножающихся и неполовозрелых дискусов (one-way ANOVA, F3,39=5.077, P<0.05, N=12 или 8; Таблица 1).
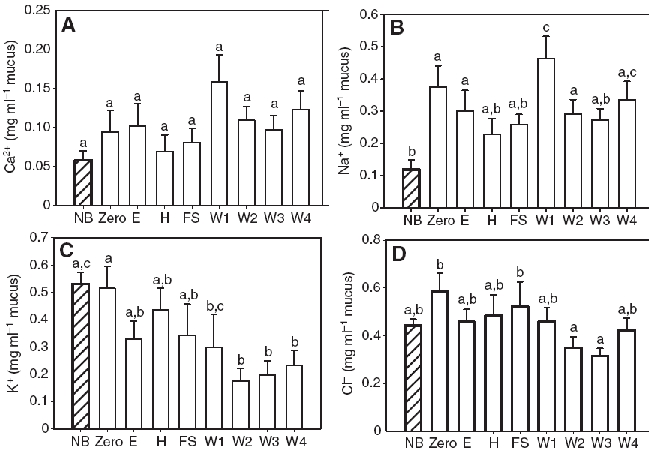
Концентрация (A)кальция, (B) натрия, (C) калия и (D) хлорида в слизи неполовозрелых дискусов (NB; N=8) и производителей (N=12). Различными буквами отмечены значимые отличия (paired t-test и постфактум тест минимальных значимых различий LSD, P<0.05); столбцы без букв не показали статистически значимых различий. Данные представлены как среднее ± стандартная ошибка средней.
Ионы
Кальций (Рисунок 6A) являлся единственным ионом, который не проявлял значимых различий между производителями на различных сроках воспроизводства (RM ANOVA, F1,7=2.333, P=0.139), между не размножающимися и размножающимися особями (one-way ANOVA, F8,87=1.470, P=0.180), а также между дикими и аквариумными производителями и не размножающимися особями (one-way ANOVA, F3,35=2.731 P=0.60; Таблица 1). Значение натрия (Рисунок 6B) на этапе W1 было значимо выше (RM-ANOVA, F1,7=3.287, P<0.05, N=12) по сравнению с периодами E, H, FS, W2, W3 и нулевого. неполовозрелые особи также имели уровень Na+, чем производители на временных интервалах — нулевом, E, W1, W2 и W4 (one-way ANOVA и постфактум LSD, F8,97=2.956, P<0.05, N=12 или 8; Рисунок 6). Сравнения между дикими и аквариумными особями также продемонстрировали значимо более высокий уровень Na+ в слизи диких дискусов (one-way ANOVA, F3,39=4.128, P<0.05, N=12 или 8; Таблица 1). Концентрация K+ в родительской слизи (Рисунок 6C) в течение нулевого периода был значимо выше (RM-ANOVA, F1,7=5.274, P<0.001, N=12), чем на этапах W1, W2, W3 и W4. неполовозрелые особи имели значимо более высокий уровень K+ по сравнению с производителями на этапах W2, W3 и W4 (one-way ANOVA, F8,97=2.485, P<0.05, N=12 или 8; Рисунок 6). Сравнения между дикими и аквариумными рыбками показали более высокую концентрацию K+ в слизи производителей дикого типа по отношению к диким и аквариумным не размножающимся особям и аквариумным производителям. (one-way ANOVA, F3,39=9.830, P<0.001, N=12 или 8; Таблица 1). Концентрация хлорида (Рисунок 6D) была значимо выше в слизи производителей (RM-ANOVA, F1,7=2.666, P<0.05, N=12) на временных участках – нулевом и FS, чем на W2 и W3. Дикие производители имели значимо более высокий уровень Cl– в слизи по отношению к аквариумным дискусам (one-way ANOVA, F3,39=26.070, P<0.001, N=12 или 8; Таблица 1).
Кортизол
Хотя не наблюдалось значимых различий в уровне кортизола у производителей в течение всех этапов воспроизводства (Рисунок 7) (RM-ANOVA, F4,1=0.446, P=0.775), кортизол в слизи производителей был значимо выше по отношению к не размножающимися особями (one-way ANOVA, F5,64=2.686, P<0.05, N=12 или 8; Рисунок 7). Аквариумные производители также обладали более высоким содержанием кортизола, чем дикие производители и неполовозрелые дискусы (oneway ANOVA, F3,39=17.894, P<0.001, N=12 или 8; Таблица 1).
Похожие статьи:
Систематика, таксономия и классификация амазонских дискусов рода Symphysodon с позиции молекулярных методов
Дискус