
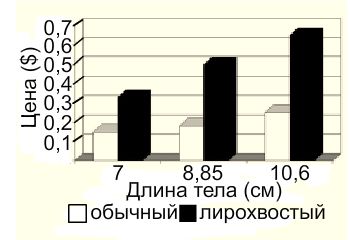
Лирохвостая порода меченосца впервые получена Доном Адамсоном (Don Adams), фермером из Флориды, которая позднее была выделена как отдельная вариация (Gordon and Axlerod, 1968). У данного типа нижний и верхний луч хвостового плавника удлинены и напоминают греческий музыкальный инструмент, что определило название — «лирохвост».
Интересно, что удлинение лучей не ограничивается лишь хвостом, все плавники длинные. Изумительный фенотип особей сильно отразился на их коммерческой ценности по сравнению с диким типом меченосцев.
Содержание
Затруднения в разведении лирохвостых меченосцев

Удлиненные плавники, характерные для данной вариации, препятствуют самцам спариваться естественным путем. С другой стороны, сперма самцов вполне жизнеспособна, а ограничения накладывает лишь слишком длинный гоноподий. Многие разводчики лирохвостой линии решают эту проблему скрещиванием лирохвостой самки с обычным самцом меченосца. Однако в данной ситуации потомство включает только 50% особей с необходимым фенотипом, что крайне непродуктивно. Внедрение новых методов скрещивания значительно повысит коммерческую выгоду от разведения данной вариации меченосцев.
Для оптимизации процесса разведения необходимо понять поведение генов (и их аллелей) при переходе от одного поколения меченосцев к другому. Имеется два варианта одного гена (лирохвостого и обычного меченосца), называемые аллелями. Каждая рыбка несет два аллеля, одна из которых наследуется от матери, а другая от отца. Для описания скрещивания необходимо задать названия лирохвостой аллели и обычной — «L» и «l», соответственно.
| l | l | |
| L | Ll | Ll |
| l | Ll | ll |
В таблице продемонстрирована схема скрещивания лирохвостой самки (генотип — слева) и обычного самца (генотип — справа).
Предполагается, что аллель лирохвоста является доминантной. В таблице представлена самка, которая несет генотип, состоящий из одной доминантной аллели и рецессивной. Генотип самца представлен двумя рецессивными аллелями. Решетка Пиннета позволяет изобразить процесс слияния половых клеток и возможные генотипы потомства. В итоге потомство получается лишь двух генотипов — Ll и ll. Это указывает на то, что следующее поколение будет включать два фенотипа в примерно равном числе особей.
Повышение количества лирохвостых особей
Согласно принципу наследования признака, при скрещивании самца и самки лирохвостой линии можно ожидать 75% лирохвостого потомства и 25% обычных меченосцев. В данном случае потребуется метод искусственного оплодотворения, который практикуется на живородящих карпозубых уже более 50 лет (Clarke, 1950; Takeshita, 2001). Он предполагает искусственное оплодотворение самок спермой, извлеченной из самцов. Данный метод удачно опробован на особях, имеющих длину свыше 5 см (без хвоста) и массу 3 г.
Гомозиготный генотип лирохвостов
При скрещивании гетерозигот лирохвостой линии получается примерно 25% гомозиготного потомства LL. Полученные особи при спаривании производят 100% лирохвостого потомства, и их коммерческая ценность очень высока. Однако для определения гомозиготности меченосцев необходимо провести ряд анализирующих скрещиваний предполагаемых гомозиготных LL самок с обычными самцами. Если после спаривания появились обычные особи, то самка гетерозиготна.
Искусственное оплодотворение меченосца
Искусственное оплодотворение часто применяется с целью повышения количества потомства ценных и редких видов животных. Техника предполагает сбор спермы у самцов с последующим инъецированием её самкам. Метод применяется в ситуации, когда самец не может естественным путем спариваться с самкой.
Kazianis et al. (2002) при проведении искусственного оплодотворения представителей рода Xiphophorus отметил ряд аспектов:
1. Оплодотворение рыб рода Xiphophorus является внутренним;
2. Сперма может оставаться жизнеспособной в теле самки в течение нескольких месяцев;
3. Самцы не всегда продуцируют сперму; и
4. Самки могут быть физиологически не готовы к деторождению, в частности, старые самки.
Материалы и методика
Инструменты
Пипетка Пастера (стекло)
Шприц инсулин-туберкулиновый (1 мл)
игла для подкожных инъекций калибра 22 (1,5 дюйма)
остроконечный глазной пинцет
английская булавка
ножницы
спиртовая горелка
остроносые плоскогубцы
мелкозернистый надфиль
чашка петри
марля
микроскопные стекла
анестетик (гвоздичное масло, MS22 или 2-феноксиэтанол)
микроскоп
увеличительные очки
солевой раствор (0,9% NaCl)

Для осуществления искусственного оплодотворения требуется несколько инструментов. Один из них, предназначенный для переноса спермы от самцов самкам (впервые описан Takeshita, 2001), представляет собой пипетку Пастера, кончик которой вытянут в тонкую канюлю. Для вытягивания кончик пипетки некоторое время держат над спиртовкой, а затем при помощи плоскогубцев вытягивают в тонкий капилляр. Значительная часть капилляров ломается во время данной процедуры, и их необходимо дополнительно отшлифовать надфилем. Желательно сделать сразу несколько капилляров. Вторым инструментом является 1 мл инсулиновый шприц с иглой 22 калибра, длиной 1,5-3,5 мм. Мелкодисперсный надфиль, либо точильный камень используется для притупления иглы.
Искусственное оплодотворение требует много мелкой работы во время сбора спермы и непосредственно осеменения самок. По этой причине рекомендуется оснаститься простейшим световым микроскопом или парой увеличительных стекол. Перед началом процесса необходимо попрактиковаться в манипулировании предметами при наблюдении через микроскоп. Удивительно, какая степень координации должна быть, чтобы производить точные движения.
Анестезия
Оплодотворения является большим стрессом для рыбок. Для предотвращения травмирования и стресса используют анестетики. В настоящее время наиболее распространенны в аквариумном рыбоводстве: гвоздичное масло, MS-222 или 2-феноксиэтанол. Как видно на рисунке, эти вещества очень близкие по структуре.
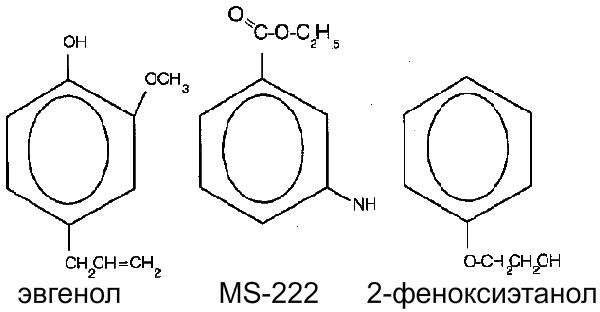
При использовании того, либо иного анестетика необходимо учитывать его стоимость, пригодность, силу, побочное действие или вредность для самой рыбки и человека. Всем требованиям удовлетворяет гвоздичное масло, которое выделяют из растения Eugenia aromatica (Tamaru et al., 1995).
Для получения маточного раствора (10%) применяют инсулиновый шприц, смешивают 1 мл масла в 9 мл воды. При разведении 0,1 мл/л — 1 мл маточного раствора смешивают в одном литре воды; 0,05 мл/л — 0,5 мл раствора на литр воды и т.д..
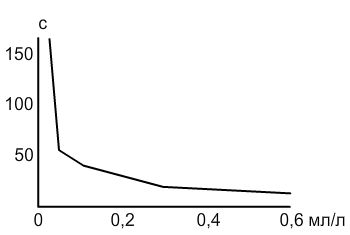
Проверка работы наркоза осуществляется на особях массой 14.0 ± 2.0 г и длиной 8.0 ± 0.6 см. 5 рыбок помещаются в каждый раствор с разной концентрацией анестетика и засекается время, в течение которого меченосцы потеряли равновесие. Реакция на концентрацию 0,1 мл/л обычно характеризуется потерей равновесия на 50-150 секунд. Однако дозы свыше 0,1 мл/л приводят к незначительному увеличению времени действия наркоза (до 1 минуты). На практике ни одна особь не погибла в течение 72 часов после обработки.
MS-222 или Трикаина метансульфонат рассматривается как один из самых эффективных анестетиков. Обычно данное вещество продается в виде хорошо растворимого в воде белого порошка. Для приготовления маточного раствора 5 г MS-222 добавляют в 1 литр воды и перемешивают до полного растворения. Полученная смесь может храниться до 6 месяцев в холодильнике при температуре 5° C. На каждый литр воды, в которую помещена рыбка, вливают 10 мл анестетика. Превышение дозы приведет лишь к незначительному продлению действия препарата (как и в случае с гвоздичным маслом).
2-феноксиэтанол продается как прозрачная жидкость, которую разбавляют до 0,2-0,3 мл/л. В данной концентрации рыбки теряют равновесие на 1-2 минуты и восстанавливаются в течение 2-5 минут.
Процедура
1. Химические растворы. Необходимо капнуть на предметное стекло солевым раствором. Подготавливают растворы для наркоза;
2. Сбор спермы у самцов. Существует два способа для сбора спермы.
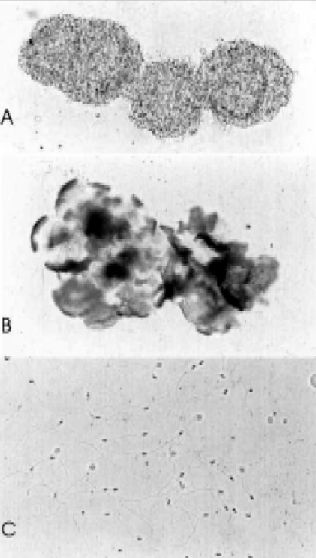
а. Если аквариумист желает сохранить жизнь своему меченосцу, то процедура проходит по первому сценарию. Проводится отлов и наркотизация. Рыбка помещается на марлю или ватный тампон и большим и указательным пальцем зажимается вверх брюшком. Другой рукой берутся за кончик гоноподия и 10 раз двигают в передне-заднем направлении. Оказывая небольшое давление, проводят большим пальцем от жабр навстречу гоноподию. Сперма выделяется из гонопора немного спереди основания гоноподия. Если самец зрелый, то будут выделятся пакеты спермы белого или слегка кремового цвета. Её собирают пипеткой, так много, насколько это возможно. Сперму переводят в солевой раствор на предметное стекло. После сбора меченосца переносят в отдельный аквариум с чистой водой. В случае, когда сперма не выделяется, самца можно использовать по второму способу.
б. Самца помещают в гвоздичное масло концентрацией >0,6 мл/л и декапитируют ножницами. Затем делают разрез брюшной полости от ануса до жабр. Освобождают доступ к целомической впадине, где располагаются семенники. Семенники представляют собой беловатый парный орган спереди гоноподия и обычно прилегает к передней целомической стенке. Семенники полностью удаляются и помещаются в солевой раствор под предметное стекло. Затем для выделения пакетов со спермой семенники разрезают на части глазным пинцетом. Стоит отметить, что пакеты со спермой, полученные первым и вторым путем будут различаться. Если поместить поверх спермы покровное стекло, то можно будет увидеть отдельные половые клетки. Различия характеризую разную степень зрелости самцов и половых клеток.
Тем не менее, оба метода пригодны для искусственного оплодотворения самок.
Подготовка самки
Выбирают девственную самку и проводят наркотизацию. Используя ватный тампон или марлю, помещают самку вверх брюшком между большим и указательным пальцем. Проводят открытой английской булавкой вдоль тела самки, вводят заточенный кончик в яйцевод. Аккуратно вводят булавку внутрь яйцевода на глубину около 1,6 мм. Это обеспечит открытие яйцевода, позволяя сперме пройти до яичников.
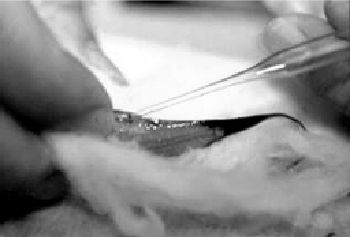
Оплодотворение
Используя стеклянную пипетку с модифицированным кончиком или инсулиновый шприц, забирают примерно две капли или 10 пакетов спермы. Вводят кончик стеклянной пипетки или шприц в яйцевод параллельно английской булавки. В зависимости от размера самки, ход капилляра составляет 1,6-3,5 мм. Одного оплодотворения должно хватить на несколько родов.
Восстановление
После всех процедур обработанные особи помещаются в аквариум с чистой водой. После того как рыбки начнут свободно плавать, возвращают их в общий аквариум. Самке требуется рацион, богатый белками (40-50 % белка) и жирами (10-15 %) (Tamaru et al., 2001). Если имеется возможность, рыбок кормят личинками комаров, дафнией (Tamaru et al., 1997). Спустя 3 недели у самки появляется темное родимое пятно сзади брюшка, что свидетельствует об удачном оплодотворении. В это время самку отсаживают в отдельный аквариум во избежание каннибализма среди рожденных мальков. Самцов можно каждые две недели использовать для отбора спермы согласно первому способу.
——
Clarke, E. 1950. A method for artificial insemination. Science 112:722-723.
Gordon, M. and H.R. Axelrod. 1968. Swordtails for the advanced hobbyist. T.F.H. Publications Inc. 96 pp.
Kazianis, S., D. Trono and A. Woodhead. 2002. Artificial insemination of Xiphophorus.
Takeshita, G. 2001. Artificial insemination of fancy swords, variatus, moons and mollies. Tropical Fish Hobbyist, Volume XLIX (9) #542:108-116.
Tamaru, C.S., C. Carlstrom-Trick, W.J. FitzGerald, Jr. 1995. Clove oil, Minyak Cengkeh, a natural fish anesthetic. Sustainable Aquaculture 95′, PACON International, Honolulu, Hawaii, 11-14 June, 1995.
Tamaru, C.S., H. Ako and R. Paguirigan. 1997. Essential fatty acid profiles of maturation feeds used in freshwater ornamental fish culture. Hydrobiologia 358:265-268.
Tamaru, C.S., B. Cole, R. Baily, C. Brown and H. Ako. 2001. A manual for commercial production of the swordtail, Xiphophorus helleri. United States Department of Agriculture, Center for Tropical and Subtropical Aquaculture, Publication Number 128. 36 pp.
оригинал — Kathleen McGovern-Hopkins, Clyde S. Tamaru, Ph.D., Glenn Takeshita and Mike Yamamoto, M.S. Procedural Guide for the Artificial Insemination of the Lyretail Swordtail, Xiphophorus helleri
Похожие статьи:
Меченосец Монтесумы
Поляризованный орнамент меченосцев
Мочеиспускание в контексте коммуникации меченосцев
Зеленый меченосец
Сортировка и отлов меченосцев на продажу. 3 часть