 В ресничной инфузории Ichthyophthirius multifiliis, которая является распространенным паразитом пресноводных рыб, была обнаружена эндосимбионтная бактерия. При ПЦР-амплификации ДНК двух изолированных штаммов инфузорий, использовалались праймеры, которые связывали консервативные последовательности бактериальных 16S рРНК генов, создавая 1460-bp ДНК продукты, которые клонировались и секвенировались. Анализ последовательности показал, что в продуктах полимеразной цепной реакции присутствуют 16S рРНК последовательности генов от трёх классов бактерий. Данные классы включают: Alphaproteobacteria (Rickettsiales), Sphingobacteria, и Flavobacterium columnare. Окрашивание ДАПИ (4,6-Диамидино-2-фенилиндол) (DAPI) показало представленность эндосимбионтов в цитоплазме трофонтов и, большинстве, но не всех теронтов. Эндосимбионты наблюдались при использовании просвечивающей электронной микроскопии в цитоплазме, окруженной выдающимся, электрон-просвечивающим ореолом риккетсий. Флюоресцентная гибридизация in situ продемонстрировала, что бактерии из классов Rickettsiales и Sphingobacteriales являются эндосимбионтами I. multifiliis, будучи обнаруженными в цитоплазме, но не в макронуклеусе или микронуклеусе. В противоположность этому, F. columnare не были найдены за счёт флюоресцентной гибридизации in situ. Вероятно, они соединялись с ресничками инфузории. Роль данных эндосимбионтных бактерий в жизни I. multifiliis неизвестна.
В ресничной инфузории Ichthyophthirius multifiliis, которая является распространенным паразитом пресноводных рыб, была обнаружена эндосимбионтная бактерия. При ПЦР-амплификации ДНК двух изолированных штаммов инфузорий, использовалались праймеры, которые связывали консервативные последовательности бактериальных 16S рРНК генов, создавая 1460-bp ДНК продукты, которые клонировались и секвенировались. Анализ последовательности показал, что в продуктах полимеразной цепной реакции присутствуют 16S рРНК последовательности генов от трёх классов бактерий. Данные классы включают: Alphaproteobacteria (Rickettsiales), Sphingobacteria, и Flavobacterium columnare. Окрашивание ДАПИ (4,6-Диамидино-2-фенилиндол) (DAPI) показало представленность эндосимбионтов в цитоплазме трофонтов и, большинстве, но не всех теронтов. Эндосимбионты наблюдались при использовании просвечивающей электронной микроскопии в цитоплазме, окруженной выдающимся, электрон-просвечивающим ореолом риккетсий. Флюоресцентная гибридизация in situ продемонстрировала, что бактерии из классов Rickettsiales и Sphingobacteriales являются эндосимбионтами I. multifiliis, будучи обнаруженными в цитоплазме, но не в макронуклеусе или микронуклеусе. В противоположность этому, F. columnare не были найдены за счёт флюоресцентной гибридизации in situ. Вероятно, они соединялись с ресничками инфузории. Роль данных эндосимбионтных бактерий в жизни I. multifiliis неизвестна.
Ресничная инфузория Ichthyophthirius multifiliis является облигатным паразитом пресноводных рыб, которая поражает эпителий кожи и плавников. Жизненный цикл паразита состоит из трёх стадий: инфекционный теронт, паразитический трофонт и воспроизводящийся томонт. Заражение происходит через кожу и плавники свободноплавающей рыбы, когда грушевидные теронты длиной 40-мкм проникают через несколько клеточных слоёв внутрь эпителиальной ткани, а затем быстро дифференцируются в трофонтов. Трофонты питаются эпителиальными клетками и достигают до 500-800 мкм в диаметре, вызывая обширные повреждения кожи и плавников, которые при серьёзном течении приводят к гибели (10-12). После 5-7-ми дневного питания трофонты покидают хозяина, формируя инкапсулированные томонты. Последние за 18-24 часа подвергаются 10 клеточным делениям, воспроизводя целых 1000 дочерних клеток, которые покидают цисту уже в качестве заразных теронтов. На всех стадиях развития Ichthyophthirius multifiliis обладает ресничками (9).
При секвенировании ДНК генома I. multifiliis в Институте J. Craig Venter исследователи неожиданно обнаружили, что последовательности бактериальной ДНК, включающие последовательности гомологичные ДНК Риккетсий, присутствовали в ДНК препаратов (R. S. Coyne, 2009 [https://www.jcvi.org/cms/research/projects/ich/overview]). Происхождение данных последовательностей неясно, но они представляют свидетельства для любого горизонтального перемещения генов в геноме I. multifiliis (17, 27), либо присутствие внутриклеточных бактерий. Ранее не было доказательств, говорящих о существовании внутриклеточных бактерий внутри I. multifiliis, даже после детального исследования структуры теронтов и трофонтов с помощью просвечивающей электронной микроскопии (10-12). Внутриклеточные или эндосимбионтные бактерии, однако, обычно обнаруживаются у простейших, и около 200 ресничных видов скрывают интрацеллюлярных бактерий (13, 15). Соннеборн (Sonneborn) и Преер (Preer) в своих классических работах на эндосимбионтах у инфузории Paramecium охарактеризовали ряд различных эндосимбионтов, включая “убийц”, названных так за их способность уничтожать неинфецированные штаммы Paramecium. Цитоплазматические эндосимбионты у Paramecium сейчас включают Caedibacter taeniospiralis (Gammaproteobacteria), и Pseudocaedibacter conjugates, Tectibacter vulgaris, и Lyticum flagellatum (Alphaproteobacteria). Макронуклеарные эндосимбионты включают Alphaproteobacteria, Holospora caryophila, и Caedibacter caryophila, которые также могут заражать цитоплазму (4, 16, 22, 26). Роли данных организмов в жизни простейших подробно не изучены.
Присутствие последовательностей с гомологией к бактериальному геному говорит о наличии у I. multifiliis эндосимбионтов, либо о горизонтальном переносе генов в геноме I. multifiliis. В рамках данной работы было идентифицировано два эндосимбионта, у двух различных изолированных инфузорий, что свидетельствует о присутствии внутриклеточных симбионтов в инфузориях I. multifiliis. Тем не менее, физиологические взаимодействия между I. multifiliis и его резидентами неизвестны. Неясно, вносят ли бактерии свой вклад в развитие инфузорий, в тяжесть или патогенность инфекции или обеспечивают какие-либо другие селективные преимущества, как это видно на примере Paramecium, содержащего бактерии убийцы (4). Неопределенно их воздействие на иммунный ответ рыб, зараженных I. multifiliis. Возможно, что они являются просто паразитами, которые проживают на паразитических ресничных инфузориях.
 Таблица 1. Олигонуклеотидные пробы, использованные в работе.
Таблица 1. Олигонуклеотидные пробы, использованные в работе.
Материалы и методы
I. multifiliis. I. multifiliis штаммы сохранялись при помощи серийного пассажа на ювенильном канальном соме (Ictalurus punctatus) как описано ранее (31). Штамм G5 (серологический тип D) был изолирован из сомов альбиносов, разводимых в местном аквариуме в 1995 году, а позднее работа производилась на ювенильных канальных сомах (31). Штамм G13 (серотип без характеристики) изолирован в сентябре 2008 года из американского пескаря (Rhinichthys cataractae), выловленного в 2008 году из реки Купер-Крик, Джорджия. Затем G13 развивался на ювенильных канальных сомах в условиях лаборатории.
Изолирование ДНК, ПЦР, клонирование и секвенирование. Томонты и теронты собраны от инфицированных канальных сомов как описывалось ранее (31). Медленно-плавающие G5 томонты были отдельно изолированы при помощи лабораторной пипетки. Они были помещены в расчете 1 и 2 мкл отфильтрованной через древесный уголь водопроводной воды (CFW) после кристаллизации на один томонт в 25 мл стерильной CFW, содержащей 100 мг/мл нормоцина, и держались в течение 1 часа при температуре 40C для контроля роста экстрацеллюлярных бактерий. Затем при помощи лабораторной пипетки они вводились в свежий CFW и перемещались в 2 мл пробирку микроцентрифуги для изоляции ДНК. Быстро-плавающие G13 теронты собирались, как описано ранее (31). Они дважды промывались в 100 мл CFW при помощи центрифугирования при 500 Х г в течение 2 мин в 100 мл пробирке для тестирования масла. После этого, теронты перемещались в 2-мл пробирки для центрифугирования и собирались при помощи центрифугирования при 500 Х г в течение 2 мин. ДНК готовилась из томонтов и теронтов при лизисе клеток в 0,5 М этилендиаминтетрауксусной кислоты (EDTA), 1% р-р додецилсульфата натрия, и 10 мМ Tris (pH 9,5) при 650C в течение 20 минут, а затем следовала инкубация в 0,5 мг/мл проназы в смеси с 0,5 М EDTA, 0,6% р-ра додецилсульфата натрия и 10 мМ Tris (pH 9,5) при 560C в течение 18 часов. ДНК изолировалась при помощи фенол-хлороформной экстракции, осаждения с этанолом и выделением в осадок с 10 мМ Tris — 1 мМ EDTA (pH 8,0) (8).
ПЦР-амплификация бактериальной 16S рРНК выполнялась с использованием универсальных праймеров, которые нацеливались на очень консервативные области 16S рРНК генов бактерии (32). Последовательность переднего праймера была 5’ GTTTGATYMTGGCTCAG 3’ (от 11 до 27 основания генов 16S рРНК Escherichia coli) (Y = C + T и M = A + C) и последовательность обратного праймера была 5’ GGHTACCTTGTTACGACT 3’ (от 1492 до 1509 основания генов 16S рРНК E. coli) (H = A + T + C) (6, 32). Дегенерация в последовательностях праймеров вводила основания на последовательностях ПЦР праймеров, используемых для амплификации генов 16S рРНК других эндосимбионтов, включающих Rickettsia sp. и Caedibacter sp. (3, 5). Полимеразная цепная реакция выполнялась с использованием Платиновая ДНК-полимераза, Taq (Invitrogen) в амплификаторе компании MJ Research колбах горячего запуска в окончательном объеме 50 мкл, содержащего 0,5 мкг ДНК. Следующие условия включали: 940C в течение 2 минут; 30 циклов при 940C в течение 30 секунд, 460C на 30 секунд и 680C на 1,5 минуты; окончательная выдержка составляла 680C на 5 минут. Амплифицированная ДНК от каждой реакции разделялась в 1% агарозном геле, окрашивалась бромистым этидием и фотографировалась с использованием системы GelDoc (Bio-Rad). Амплифицированные ПЦР продукты очищались в 1% р-ре агарозного геля, лигировались вектором pCR8/GW/TOPO и трансформировались в E. Coli с применением клонированного комплекса pCR8/GW/TOPO TA, следуя инструкциям изготовителя (Invitrogen). Отдельные колонии собирались, затем росли всю ночь, а после выделялись плазмидные ДНК. Клонированные вставки секвенировались с применением ДНК секвенатора ABI3730 на оборудовании ДНК секвенирования университета Джорджии.
Сравнительный анализ последовательностей. Последовательности просто находились по общедоступной базе с использованием программы BLASTN, доступной на сайте Национального Центра Биотехнологической информации. Филогенетическое древо строилось с помощью программы MEGA4 (28). Данные рассматривались на минимальном эволюционном отрезке, минимальном уровне объединения соседей и максимально экономных алгоритмах, использующих “bootstrap” анализ 1000 репликантов.
Пробы. EUB338 проба связывает высоко консервативные области в 16S рРНК бактерии и является специфической для домена (надцарства) бактерий (1). Олигонуклеотидные пробы, специфические для 16S рРНК последовательностей бактерий Rickettsiales, Sphingobacteriales, и Flavobacterium columnare, идентифицировали в данной работе при использовании программного обеспечения Primer3 и представлены в таблице 1 (23). С 5’ конца пробы помечались флюоресцентными красителями Cy3 или Cy5 (Integrated DNA Technologies). Образцы создавались для нацеливания на области ограниченных вторичных структур в 16S рРНК, основанных на структуре 16S рРНК E. Coli (33). В каждом случае синтезировались две комплементарные пробы: одна комплементарная для 16S рРНК последовательности, а вторая с такой же последовательностью как у транскрибируемой 16S рРНК, которая работала в качестве негативного контроля для определения неспецифического связывания. Образцы использовались по одиночке, либо в комбинации с EUB338, который работал в качестве позитивного контроля флюоресценции в экспериментах с in situ гибридизацией (FISH).
DAPI окрашивание. Окрашенные клетки 4’,6-диамидино-2-фенилиндол теронтов и томонтов фиксировались в 3% формальдегиде в CFW при 40C в течение 1 часа. Затем они промывались в холодном 50мМ ХЕПЕС (HEPES) (pH 7.5) за счёт центрифугирования при 500 Х г в течение 30 секунд, пипеткой помещались на предметные стекла, высушивались на воздухе, инкубировались с 1 мкг/мл DAPI в 50 мМ ХЕПЕС в течение 4 минут и дважды промывались с 50 мМ ХЕПЕС.
FISH. Флюоресцентно- маркированные ДНК пробы гибридизировались с бактериальными 16S рРНК, используя модификации стандартных процедур (5). Примерно 4 Х 103 I. multifiliis теронтов в 100 мкл CFW были перемещены пипеткой на обработанные поли-L-лизином предметные стекла, вводился эквивалентный объем 80% водного параформальдегида и теронты фиксировались на 30 минут при комнатной температуре (RT). Теронты дважды промывались 10,1 мМ Na2PO4, 1,5 мМ KH2PO4, 2,7 мМ KCl и 136 мМ NaCl (фосфатно-солевой буфер) [PBS], pH 7,2 в течение 3 минут; высушивались на воздухе в течение 1 -2 часов; и хранились при температуре -200C. Приготовленные для флюоресцентной гибридизации in situ, образцы обрабатывались 1% Triton X-100 в стерильной дистиллированной воде в течение 3 минут при комнатной температуре, 100 мкг/мл протеиназой K в PBS при комнатной температуре в течение 5 минут; поэтапно дегидратировались сериями спирта (70%, 95% и 100% в течение 3 минут); высушивались на воздухе. Образцы блокировались с 0,25 мкг/мл дрожжевой тРНК в 2Х стандартной солью лимонной кислоты (SSC), 0,3 М NaCl и 0,03 М Na3C6H5O7 (pH 7.0) в течение 30 минут при комнатной температуре. Образцы инкубировались в гибридизационном растворе, содержащим 0,25 мкг/мл дрожжевой тРНК в 1,4Х SSC, 30% формамида, и 5 нг/мкл проба помещалась в темноту в увлажнительную камеру на 18-24 часа при 480C. Несвязанная проба удалялась при промывании предметного стекла в 2Х SSC в течение 10 минут при комнатной температуре, 1Х SSC в течение 10 минут при 370C, 0,3Х SSC на 10 минут при 480C и 0,3Х SSC в течение 10 минут при комнатной температуре. Предметные стёкла высушивались на воздухе, покрывались гистологической средой Vectashield (Vector Laboratories) и хранились в темноте. Теронты подвергались контрастному окрашиванию с DAPI, затем следовала флюоресцентная гибридизация in situ при помощи покрытия гистологической средой Vectashield, содержащей DAPI.
РНКазы обработка перед флюоресцентной гибридизацией in situ. Для обработки теронтов рибонуклеазой перед гибридизацией проб, они подвергались этапам флюоресцентной гибридизации in situ через протеинкиназу K и ополаскиванию. Затем они инкубировались 100 мкг/мл рибонуклеазой A и 25 единиц/мл РНКазы T1 в 300 мМ NaCl, 10 мМ Tris-Cl (pH 7,4) в течение 60 минут при 370C. Затем предметные стекла дважды ополаскивались 0,25 мкг/мл дрожжевой тРНК в 1,4Х SSC, 30% формамида в течение 5 минут при комнатной температуре, обезвоживались в этаноле, блокировались 0,25 мкг/мл дрожжевой тРНК в 2Х SSC в течение 30 минут при комнатной температуре, и гибридизировались с EUB338, как указано ранее.
Фотомикроскопия и анализ изображения. При конфокальной микроскопии предметные стекла рассматривались с использованием микроскопа Zeiss AxioImager M1, совмещенного с конфокальной сканирующей головкой LSM510 Meta и линзой нефтеносного песка Plan Apo 100Х/1.4. Флюоресцентная гибридизация in situ производилась 30-мW лазерным диодом с длиной волны 405-нм, Cy3 с 1,2-мW HeNe лазером 563-нм, и Cy5 с 5-мW HeNe лазером 633-нм, а флюоресцентные сигналы обнаруживались за счёт соответствующих пропускающих фильтров. Изображения дифференциального контраста по интерференции получались при использовании 5-мW HeNe лазера 633-нм. Изображения собирались программным обеспечением “Laser Scanning Microscope LSM510” (4.0 SP2) и обрабатывались ПО “Zeiss LSM Image Browser” (Version 4.0.0.12). Программа Zeiss LSM510 использовалась для определения колокализации сигналов от EUB338 (Cy3), а также RICP или BACP (Cy5) в теронтах, обработанных в данных пробах, подсчитывались массо-колокализационные коэффициенты Мандерса (19). Значение ноль говорило о том, что не происходило флюоресценции в Cy3 канале, колокализованной с флюоресценцией в Cy5 канале, в то время как значение 1 указывало на 100%-ую флюоресценцию в Cy3 канале, колокализованную с флюоресценцией в Cy5 канале.
Цифровые фотографии РНКазно-обработанных теронтов были сделаны цифровой камерой “Olympus Q Color-3”, установленной на микроскоп “Olympus BH-2”, использующий линзы “Plan Apo 40 /0.85“.
Электронная микроскопия. Теронты собирались при центрифугировании при 500Х г в течение 2 минут, ресуспендировали в CFW, пропускали через 40-мкм-пористый фильтр для удаления экстрацеллюлярного мусора, ополаскивались в CFW и фиксировались в эквивалентном объеме 4% глутаральдегида, 4% параформальдегида, 0,4% пикриновой кислоты и 0,2 М какодилатного-HCl буфера (pH 7,2) при температуре 40C на всю ночь. Теронты ополаскивались в 0,1 М какодилатном-HCl буфере, помещались на 3% агар, вторично фиксировались в 1% OsO4 в 0,1 М какодилатном-HCl буфере (pH 7,25) в течение 1 часа при комнатной температуре, ополаскивались дистиллированной водой, окрашивались 0,5% водным ацетатом уранила в течение 1 часа при комнатной температуре и промывались и обезвоживались поэтапно сериями этанола. Теронты помещались в 1:1 пропиленоксид эпон-аралдит, разрезались на 60-нм срезы, окрашивались 5% метанольным ацетатом уранила и цитратом свинца Рейнольда, и затем рассматривались под трансмиссионным электронным микроскопом “JEM-1210”.
Инвентарные номера нуклеотидных последовательностей. Последовательности для эндосимбионтов в данном исследовании находятся в “GenBank” под инвентарными номерами GQ870455 для клона Риккетсий c1312 и GQ870456 для клона Сфингобактерий c134.
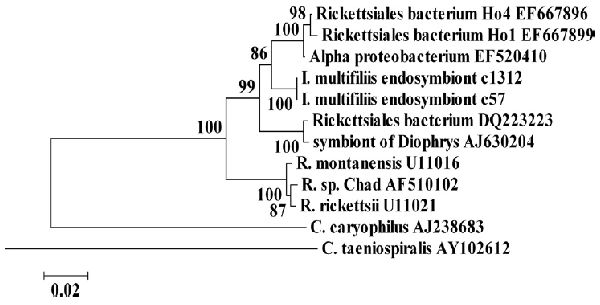
Рисунок 1. Филогенетическая взаимосвязь I. multifiliis Rickettsiales эндосимбионтов c57 и c1312. Минимальный эволюционный промежуток древа рассчитывался с использоваием генетических последовательностей 16S рРНК. Взаимосвязь I. multifiliis Rickettsiales эндосимбионтов c57 и c1312 с образцами Alphaproteobacteria, включающих некультивируемую бактерию, выделенную из гидры (EF667896 и EF667899), некультурный изолят Alphaproteobacteria (EF520410) из пресноводного озера в Адирондаке, Rickettsia sp., и два эндосимбионта Paramecium, C. caryophila (Alphaproteobacteria) и C. taeniospiralis (Gammaproteobacteria). Значения в узловых точках являются процентами от бутстрап значений, основанных на 1000 образцов. Калибровка показывает процент несоответствия последовательностей.
Результаты
ПЦР, клонирование и секвенирование. Секвенирование генома штамма G5 I. multifiliis указывает на присутствие последовательностей ДНК бактериального происхождения, включающего гомологичные Риккетсиям (R. S. Coyne, 2009 [https://www.jcvi.org/cms/research/projects /ich/overview]). Для определения того, может ли последовательности бактериального гена 16S рРНК амплифицироваться из препаратов ДНК I. multifiliis, создавались ПЦР праймеры, нацеленные на высококонсервативные области гена бактериальной 16S рРНК. ПЦР амплификация ДНК G5, выделенных из томонтов, использующих данные 16S рРНК генетические праймеры, создавали ДНК продукты 1,460 bp, которые согласовывались с прогнозируемым размером (данные не представлены). 1460-bp ПЦР продукт извлекался из агарозного геля, лигировался вектором pCR8/GW/TOPO и клонировался. Плазмидная ДНК выделялась из 6 случайно выбранных клонов и секвенировалась. BLASTN поиск по базе NCBI с данными последовательностями указал на ДНК от трёх различных классов бактерий, включающих Альфа-протеобактерии (Rickettsiales), Сфингобактерии (Emticicia), и Flavobacterium columnare, присутствующих в пробах.
Штамм G5 I. multifiliis культивировался в Лаборатории устойчивого использования морских биоресурсов “Laboratory of Marine Bio-Resource Sustainable Utilization (LMB)” с 1995 года. Для определения того, связана ли бактерия с G5, присутствовали другие штаммы I. multifiliis, включая штаммы, ранее собранные в диких популяциях рыбок, второй штамм I. multifiliis (G13) был выделен из дикой рыбы в 2008 году. Собирались G13 теронты, и изолировалась ДНК. ДНК амплифицировалась, как описано ранее, и вновь создавались 1460-bp продукты. Они клонировались, и плазмидная ДНК выделялась из 14 колоний. Секвенирование этих плазмид продемонстрировало, что последовательности гена 16S рРНК от трёх классов бактерий, обнаруживаемые в G5 ДНК препаратах, также присутствуют в G13 ДНК препарате.
Филогенез. (i) Альфа-протеобактерии (Rickettsiales). BLASTN поиск показал, что 6 клонов (от G5, c56 и c57; от G13, c1311, c1312, c1314 и c1315) имели высокую схожесть последовательности для 16S рРНК генов Rickettsiales sp. От сюда, c1312 и c1315, изолированные из G13 теронтов, имели идентичную последовательность и 99% схожестью с c57, выделенными из G5 томонтов. Три данных клона имели 96% идентичность последовательностей с генами 16S рРНК от двух некультивируемых клонов бактерии Rickettsiales, выделенных из эпителиальной ткани гидроидной Hydra oligactis и некультивируемых Альфа-протеобактерий, полученных их пресноводного озера, и 95% идентичностью с генами 16S рРНК от некультивируемых эндосимбионтов Rickettsiaceae морской ресничной инфузории Diophrys appendiculata (14, 21, 30). Они имели 93-94% идентичность для типичных видов Риккетсий, таких как R. Rickettsia. Сравнение при помощи ПО BLASTN для Paramecium эндосимбионтов показало, что они обладают 86% идентичностью с Альфа-протеобактерией C. caryophila, однако только 78% идентичностью с Гамма-протеобактерией C. taeniospiralis (5, 16, 22). Филогенетические древа для клонов c57 и c1312 построены с использованием MEGA4 эволюционного минимума, минимума объединения соседей и максимально экономных алгоритмах (28). Данный метод сгруппировал все созданные идентичные клоны и показал, что кластеры клонов c57 и c1312 наиболее близки с двумя некультивируемыми клонами бактерий Риккетсий, выделенных из эпителия гидроидной H. Oligactis и некультивируемой Альфа-протеобактерии, полученной из пресноводного озера, и менее близки к Paramecium endosymbionts (Рисунок 1).
Вторая группа клонов, включающая c56, c1311 и c1314, имела 95-99% идентичность между собой, но только 90-93% идентичность с c1312. Данные клоны являлись химерами последовательностей Rickettsiales и F. columnare. Последовательности этих клонов и c1312 на 99% схожи по основаниям от 1 до 1025, однако, по большей части, различаются последними 450 основаниями. Для c56, последовательность от основания 966 до 3’-конца (основание 1452) было на 99% идентично основаниям от 1018 до 1474 для последовательности гена 16S рРНК F. columnare, определенной в данном исследовании. Урезанные ПЦР продукты, оканчивающиеся около оснований 966 до 1025 потенциально могли связываться со своей комплементарной последовательностью в ПЦР продуктах F. columnare и служить праймером в полимеразной цепной реакции для создания химерных клонов. Химерные клоны обычно создавались от ДНК препаратов, содержащих многие виды (2).
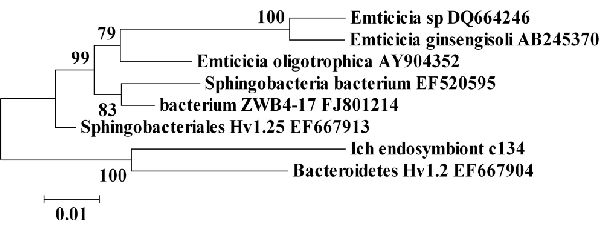
Рисунок 2. Филогенетическая взаимосвязь I. multifiliis Sphingobacteria эндосимбионта c134. Минимальный эволюционный промежуток древа рассчитывался с использоваием генетических последовательностей 16S рРНК. Показана взаимосвязь I. multifiliis Sphingobacteria эндосимбионта c134 с некультивируемой бактерией, выделенной из Hydra (EF667904 и EF667913), некультивируемой бактерией, выделенной из пресноводных озёр (EF520595 и FJ801214) и Emticicia. Значения в узловых точках являются процентами от бутстрап значений, основанных на 1000 образцов. Калибровка показывает процент несоответствия последовательностей.
Сфингобактерии. BLASTN поиск показал, что другие 4 клона обладали существенной идентичностью последовательностей (от G5, c53; от G13, c134, c135 и c1313). Они продемонстрировали 94% схожесть с геном 16S рРНК некультивируемой Bacteroidetes Hv1.2 и 93% идентичность с некультивируемой Sphingobacteriales Hv1.25. Hv1.25 и Hv1.2 бактерии также были выделены из эпителиальной ткани гидры, в данном случае, H. vulgaris (14). c134 также показала последовательность, идентичную с некультивируемой Sphingobacteria, выделенной из пресноводного озера (21) и с тремя видами мало описываемого рода Emticicia: 92% с E. oligotrophica (24), 89% с Emticicia sp. (7) и 89% с E. ginsengisoli (18).
Последовательность c134 использовалась для построения филогенетического древа с минимальным эволюционным промежутком, количеством предков и максимально экономными алгоритмами, все из которых обладали схожей топологией (28). Все три алгоритма группировали c134 наиболее тесно с Bacteroidetes Hv1.2 и Sphingobacteriales Hv1.25, выделенными из H. Vulgaris и рода Emticicia (Рисунок 2). Основываясь на этих данных, клоны могут представлять новые виды внутри рода Emticicia и класса Sphingobacteria.
Флавобактерии. Другие 10 клонов обладали высокой схожестью последовательностей, и показали 97-100% идентичность с последовательностью гена 16S рРНК F. columnare (данные не представлены). F. columnare населяют кожу рыбы (29). Потенциал для заражения ДНК препаратов I. multifiliis образцами F. columnare, либо другими бактериями из рыбьей кожи или аквариумной воды, предвиделся, но ярко не наблюдался.
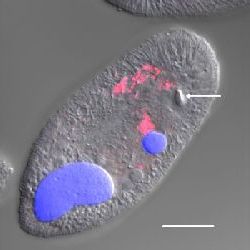
In situ гибридизация. DAPI окрашивание использовалось для определения того, могут ли эндосимбионты находится в I. multifiliis. Теронты и томонты окрашивались при помощи DAPI и рассматривались под конфокальным микроскопом, который выявлял DAPI-позитивных эндосимбионтов в цитоплазме, в дополнении к ярко окрашенному макронуклеусу и микронуклеусу. У теронтов, DAPI-окрашиванные эндосимбионты концентрировались в середине и на периферии теронта, с немногими вкроплениями, видимыми спереди и сзади. Ряд эндосимбионтов, обнаруженных за счет DAPI в теронтах, варьировал от рассеянных до плотных концентраций, которые препятствовали точному подсчету количества эндосимбионтов. В томонтах, большое количество DAPI-окрашенных эндосимбионтов было представлено на всём протяжении цитоплазмы (Рисунок 3).
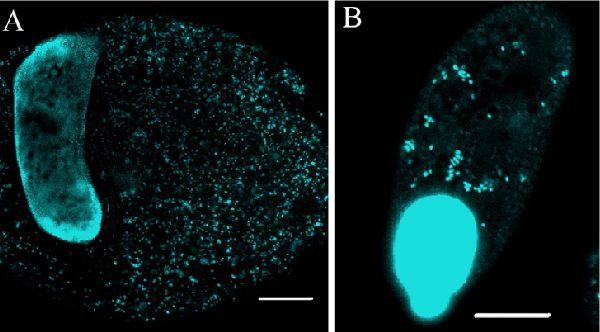
Рисунок 3. Конфокальное изображение томонта и тероннта I. multifiliis штамма G13, окрашенных DAPI. (A) DAPI-окрашенный G13 томонт, с макронуклеусом и эндосимбионтами (голубые). Калибровочная шкала, 100 мкм. (B) DAPI-окрашенный G13 теронт с изображенными макронуклеусом, микронуклеусом (сливается с макронуклеусом) и эндосимбионтами (голубые). Калибровочная шкала, 10 мкм.
Трансмиссионная электронная микроскопия срезов теронтов показала продолговатых или палочковидных эндосимбионтов, свободно представленных на всем протяжении цитоплазмы, одиночных или групп из двух или трех (Рисунок 4). Эндосимбионты не наблюдались в вакуолях или ядре, и были связаны с клеточными органеллами. В срезах, эндосимбионты имели размер от 0,35-0,43 до 0,53-0,99 мкм, что схоже с Риккетсиями (20, 25). Они содержали зернистую цитоплазму, внутреннюю цитоплазматическую мембрану, внешнюю оболочку (клеточная стенка), слизистый слой и были окружены ярким электрон-просвечивающим ореолом, характерным для Риккетсий (20, 25).
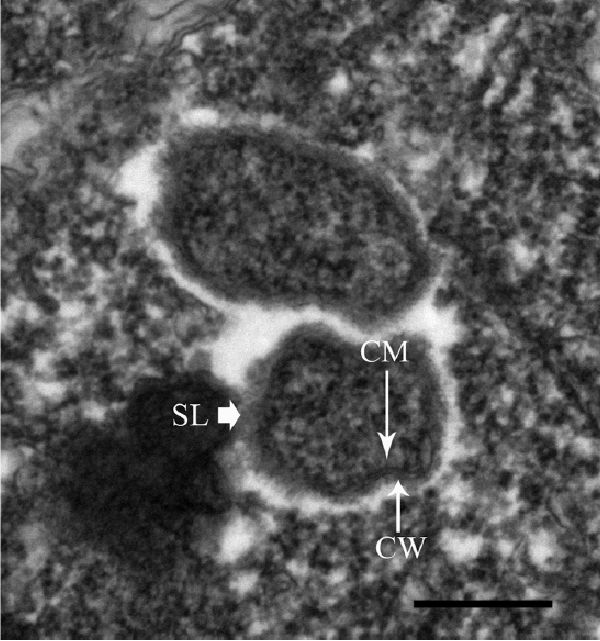
Рисунок 4. Трансмиссионная электронная микрофотография двух эндосимбионтов в теронте I. multifiliis штамма G13. Показаны внутренняя цитоплазматическая мембрана (CM), внешняя оболочка (CW) и слизистый слой (SL). Эндосимбионты окружены электрон-просвечивающим ореолом. Калибровочная шкала, 300 нм.
Флюоресцентная гибридизация in situ применялась для определения распределения внутри теронтов бактерий, обнаруженных при секвенировании. Когда теронты I. multifiliis инкубировались с пробой EUB338, которая нацеливалась на бактерии, и вторично окрашивались DAPI, паттерн гибридизации, согласующийся с DAPI-окрашиванием, наблюдался под конфокальным микроскопом, EUB338-позитивные эндосимбионты находились преимущественно в центре теронтов и были менее многочисленны около переднего или заднего края клеток. Не наблюдалось внутриядерной локализации эндосимбионтов как в макронуклеусе, так и в микронуклеусе теронтов (Рисунок 5). В противоположность этому, не обнаруживался сигнал от теронтов, когда для гибридизации использовалась проба EUBN, некомплементарная, проба негативного контроля, которая имела общую с 16S рРНК Bacteria последовательность (не показана).
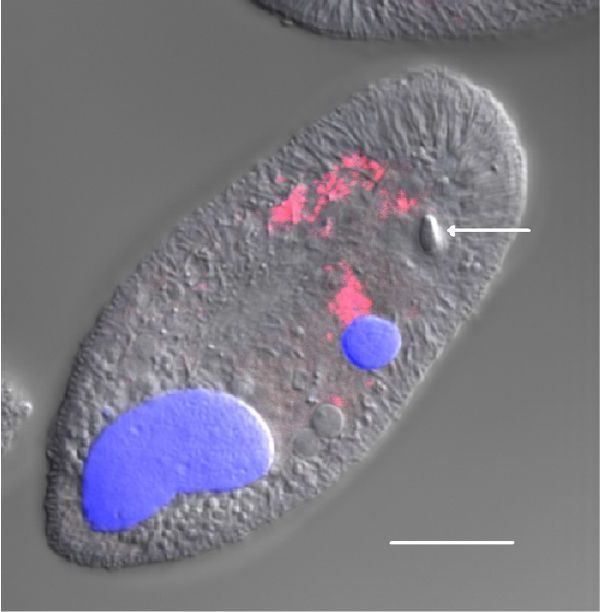
Рисунок 5. Флюоресцентная гибридизация in situ (FISH) теронта инфузории I. multifiliis штамма G5, маркированного EUB338 пробой и вновь окрашеного DAPI. Показано конфокальное изобажение лазерного сканирования. Совмещенные DIC, DAPI, и FISH изображения показывают эндосимбионтов, маркированных EUB338 пробой (красный), DAPI-окрашенный макронуклеус и микронуклеус (голубой), и органеллу Либеркюна (стрелкой). Калибровочная шкала, 10 мкм.
Для подтверждения того, что сигнал от EUB338 получен при гибридизации пробы с 16S рРНК, теронты обрабатывались 100 мкг/мл РНКазой и 25 единиц/мл РНКазой Т1 перед инкубацией с EUB338. Это приводило к потере EUB338 сигнала, подтверждая, что EUB338 проба гибридизируется с 16S рРНК в данных условиях, и показало, что данные эндосимбионты транскрибируются 16S рРНК (Рисунок 6). В некоторых теронтах, с или без обработки РНКазой, флюоресценция наблюдалась от органеллы Либеркюна, фоторецептора, найденного у некоторых ресничных (10). Эта флюоресценция согласуется с результатами автофлюоресценции или неспецифическим взаимодействием проб с этими органеллами.
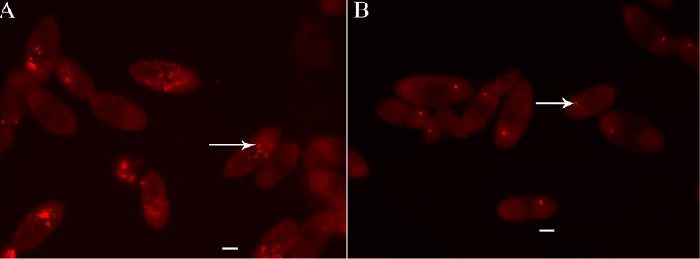
Рисунок 6. Обработка РНКазой теронтов I. multifiliis штамма G5. (A) Эндосимбионты, маркированные FISH пробой EUB338 (красный), отмечены стрелкой. (B) В теронтах, обработанных РНКазой перед гибридизацией EUB338, не обнаруживаются эндосимбионтов. Органелла Люберкюна также показана (стрелка). Калибровочная шкала, 10 мкм.
Для идентификации внутриклеточной локализации Rickettsia sp. в теронтах, G13 теронты инкубировались с EUB338 и Rickettsiales-specific RICP, или негативным контролем RICP, и >50 теронтов из двух различных экспериментов рассматривались под конфокальным микроскопом. Паттерн гибридизации с RICP был подобен тем, которые наблюдались с EUB338. RICP-позитивные эндосимбионты были обнаружены в центральной области теронтов и не соответствовали специфическим клеточным скоплениям. Не обнаруживалось окрашивание ядра. Когда теронты исследовались с EUB338 и RICP, наблюдалась EUB338 гибридизация для теронтов, однако не обнаруживалась RICP гибридизация, тем самым, подтверждая, что RICP сигнал приводит к специфической гибридизации RICP пробы 16S рРНК Rickettsiales. Конфокальное изображение поглощения EUB338 и RICP показало, что подмножество бактерий, обнаруженных за счёт EUB338, также является позитивным и к RICP. Это согласуется с результатами секвенирования, которые показывают множество видов бактерий связано с I. multifiliis (Рисунок 7). В данных экспериментах флюоресценция от органеллы Либеркюна также обнаруживается в Cy5 канале.
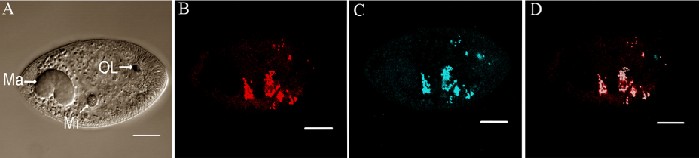
Рисунок 7. Флюоресцентная гибридизация in situ (FISH) теронтов G13, маркированных пробой EUB338 и Rickettsiales-специфичной пробой RICP. Показано конфокальное изображение лазерного сканирования. (A) DIC изображение теронта G13. Показан макронуклеус (Ma), микронуклеус (Mi) и органелла Люркюна (OL). (B) Элемент сферы одного теронта, показывающего эндосимбионтов, маркированных EUB338-пробой (красный). (C) Элемент сферы того же теронта, показывающего эндосимбионтов, маркированных RICP-пробой (синий). (D) Совмещеная фотография панелей B и C, показывающая ьелым цветом эндосимбионтов, окрашенных в обеих пробах, красным цветом бактерий, меченных только EUB338 и синим автофлюоресценцию от органеллы Люберкюна. Калибровочная шкала, 10 мкм.
Для идентификации внутриклеточной локализации Sphingobacteriales в теронтах, G5 теронты инкубировались с EUB338 и Sphingobacteriales-специфичной BACP, или BACP пробой негативного контроля. При конфокальной микроскопии BACP-позитивные эндосимбионты были обнаружены в >50 теронтах из двух различных экспериментов. Эндосимбионты находились в центральной области теронтов, и небольшая часть была представлена в переднем и заднем конце клеток. Не наблюдалось внутриядерного окрашивания. Когда теронты исследовались с помощью EUB338 и BACP, обнаруживалась EUB338 гибридизация, однако не наблюдалось BACP сигнала. Изображение поглощения EUB338- и BACP-окрашенных теронтов показало, что подмножество EUB338-позитивных бактерий также позитивно для BACP (Рисунок 8).
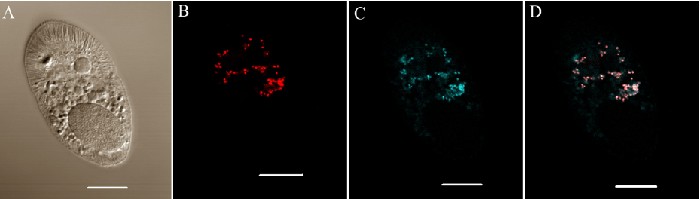
Рисунок 8. Флюоресцентная гибридизация in situ (FISH) теронтов G5, маркированных пробой EUB338 и Rickettsiales-специфичной пробой RICP. Показано конфокальное изображение лазерного сканирования. (A) DIC изображение теронта G5. (B) Элемент сферы одного теронта, показывающего эндосимбионтов, маркированных EUB338-пробой (красный). (C) Элемент сферы того же теронта, показывающего эндосимбионтов, маркированных RICP-пробой (синий). (D) Совмещеная фотография панелей B и C, показывающая ьелым цветом эндосимбионтов, окрашенных в обеих пробах, красным цветом бактерий, меченных только EUB338 и синим автофлюоресценцию от органеллы Люберкюна. Калибровочная шкала, 10 мкм.
Наоборот, не наблюдалось сигнала, когда FLAP, или, иными словами, FLAP проба негативного контроля, которая была специфична для F. columnare, применялась во время флюоресцентной гибридизации in situ. Когда теронты инкубировались с EUB338 и FLAP, они были поитивны для EUB338, однако FLAP сигнал не обнаруживался. Нехватка гибридизации FLAP для EUB338-позитивных теронтов свидетельствует о том, что F. columnare не являются эндосимбионтами I. multifiliis. EUB338 окрашивание внутриклеточных бактерий, связанных с ресничками, наблюдалось у некоторых теронтов, и наблюдались скопления DAPI-окрашенных палочковидных, внутриклеточных бактерий, связанных с ресничками и слизью на поверхности томонтов и теронтов (не показаны). F. columnare найдены в коже рыб. Эти данные свидетельствуют, что F. columnare также связаны с ресничками I. multifiliis и не могут быть уделаны промыванием. Данные внеклеточные бактериальные скопления вероятно являются источником гена F. columnare 16S рРНК, который амплифицируется при ПЦР.
Для определения распространения колокализации флюоресцентного сигнала Cy-3-меченной EUB338 пробы с Cy-5-меченными RICP или BACP пробами использовался массо-колокализационные коэффициенты Мандерса (19). Одиночные теронты зрительно были поперечно разделены в z-измерении для определения локализации EUB338 и RICP или BACP сигналов в поперечных срезах целого теронта. Средние коэффициенты EUB338 сигналов были 0,39 ± 0,006 (среднее ± стандартное отклонение) с RICP сигналом (n = 16) и 0,58 ± 0,09 с BACP сигналом (n = 10). Объединенные значения RICP и BACP сигналов рассчитывались для всех EUB338 сигналов в анализе поперечных срезов. Также были определены массо-колокализационные коэффициенты для конфокальных изображений единичных срезов, собранных из теронтов, которые обладали избирательностью по своей силе RICP и BACP сигналов. В данном случае, средние массо-колокализационные коэффициенты были 0,52 ± 0,24 для EUB338 с RICP (n = 6) и 0,9 ± 0,11 для EUB338 с BACP (n = 7). Данные образцы единичных срезов обладали завышенными коэффициентами по сравнению с EUB338 сигналом соответствующего анализа поперечного среза. Массо-колокализационные коэффициенты Мандерса, определяемые при анализе поперечных срезов, показали, что Rickettsia составляет 40% эндосимбионтов, в то время как Sphingobacteriales представляют 60%, и подтвердили тот факт, что только Rickettsia и Sphingobacteriales являются эндосимбионтами I. multifiliis штаммов G5 или G13.
Не все I. multifiliis теронты имеют эндосимбионтов. Не все теронты демонстрируют позитивный EUB338 гибридизационный сигнал (Рисунок 6). Теронты, которые не имеют EUB338 сигнал, могут не гибридизироваться с EUB338, либо могут обладать немногочисленными или вообще не иметь эндосимбионтов, и, таким образом, демонстрировать не обнаружимый сигнал, следующий после инкубации с EUB338. Для различения двух возможностей, G5 и G13 теронты окрашивались DAPI и исследовались под микроскопом для DAPI-позитивных эндосимбионтов. В итоге из проверенных 336 G5 теронтов, 219 содержали по крайней мере одного DAPI-позитивного эндосимбионта (65%). У G13, 362 теронта из 400 проверенных являлись DAPI-позитивными (91%). Данные результаты демонстрируют, что эндосимбионты обнаруживаются не у всех теронтов.
Обсуждение
До момента секвенирования генома для идентификации последовательностей ДНК, гомологичных бактериальным последовательностям, не имелось фактов, свидетельствующих о присутствии эндосимбионтов в I. multifiliis (11, 12; R. S. Coyne, 2009 [https://www.jcvi.org/cms /research/projects/ich/overview]). Эти бактериальные последовательности могут являться свидетельством горизонтального переноса гена в геноме Ichthyophthirius multifiliis, либо они происходят от эндосимбионтов инфузории (17, 27). Исследования показали, что два различные класса бактерий, Alphaproteobacteria (Rickettsia) и Sphingobacteria, обнаружены в цитоплазме Ichthyophthirius multifiliis. Массо-колокализационные коэффициенты Мандерса, рассчитанный на основе колокализационного анализа z-срезов теронтов, продемонстрировал, что сигнал от эндосимбионтов, меченных RICP или BACP пробами, колокализован с сигналом от подмножества эндосимбионтов, маркированных EUB338 пробой. Объединенные значения для массо-колокализационных коэффициентов для RICP или BACP проб рассчитывался для всех EUB338 сигналов. Это подтвердило, что Риккетсии и Сфингобактерии (Rickettsia и Sphingobacteriales) являются единственными эндосимбионтами, обнаруженными у Ichthyophthirius multifiliis штаммов G5 и G13. У теронтов, данные эндосимбионты, определяемые при помощи флюоресцентной гибридизации in situ, имеют перекрывающееся цитоплазматическое расположение, преимущественно в центральной области клеток. DAPI-окрашивание томонтов показало эндосимбионтов, представленных на всём протяжении цитоплазмы. Эндосимбионты не определялись в макронуклеусе или микронуклеусе при флюоресцентной гибридизации in situ.
Шесть клонов имели последовательности, схожие с Alphaproteobacteria и, более специфичные, для отряда Rickettsiales. Proteobacteria является эндосимбионтом многих различных видов простейших. Частицы-убийцы парамециума, впервые описанные Соннеборном в 1938 году и позднее обширно охарактериованные Преером с сотрудниками, включают как Alphaproteobacteria, так и Gammaproteobacteria (4, 5, 16, 22, 26). Rickettsiales (Alphaproteobacteria), идентифицированные сравнительно недавно в диких скоплениях различных простейших, включая ацидофильных простейших из кислых вод шахтного водоотлива, морских ресничных простейших, D. appendiculata, и Acanthamoeba, свободно-живущих амёб (3, 16, 30). Кроме того, Rickettsiales связаны с эпителием гидроидной Hydra (14). Минимальный эволюционный отрезок филогенетического древа и BLASTN поиск показали, что эндосимбионты из отряда Rickettsiales в Ichthyophthirius multifiliis демонстрируют высокую схожесть последовательностей для гена 16S рРНК Rickettsiales, выделенного из двух бактерий, связанных с эпителиальной тканью H. Oligactis.
Другие клоны обладали высокой схожестью последовательностей для генов 16S рРНК двух членом типа Bacteroidetes (некультивируемые Bacteroidetes Hv1.2 и Sphingobacteriales Hv1.25), оба из которых выделены из эпителиальной ткани H. vulgaris (14). Таким образом, оба эндосимбионта Ichthyophthirius multifiliis продемонстрировали поразительную идентичность к гену 16S рРНК бактерий, связанных с эпителиальной тканью гидры. Причина этого неясна.
Данные клоны Sphingobacteria также обладали 90% идентичностью последовательностей к трём описанных членам рода Emticicia. Виды Emticicia выделены из пресноводных прудов в Индии, Кореи и с корейского поля женьшеня. Они не были отнесены к эндосимбионтам и представлены, как развивающиеся на бедных питательными веществами угодьях (7, 18 24). Это свидетельствует о том, что данные эндосимбионты Ichthyophthirius multifiliis представляют новые и ранее неописанные Сфингобактерии, возможно связанные с Emticicia.
Последовательности других 10 клонов имели 97-99% идентичность к гену 16S рРНК рода F. columnare. Однако, флюоресцентная гибридизация in situ не установила гибридизацию FLAP пробы с EUB338-позитивными теронтами, говоря об отсутствии пренадлежности F. columnare к внутриклдеточным эндосимбионтам Ichthyophthirius multifiliis. Расчет массо-колокализационного коэффициента Мандерса показал, что объединенное значение сигнала от двух эндосимбионтов, маркированных RICP и BACP пробами вычисляется для всех EUB338 сигналов. Это подтвердило отсутствие F. columnare в ряду эндосимбионтов I. multifiliis, которая, скорее всего, является внеклеточным загрязнением. F. columnare является внеклеточной, грам-отрицательной бактерией, обнаруженной на коже и жабрах рыбы. Она условно-патогенный микроорганизм, который вызывает болезнь колумнариоз, потенциально смертельную инфекцию (29). Её присутствие, вместе с другими бактериями, также найденными в образцах воды, где собиралась I. multifiliis, было вполне ожидаемо. Таким образом, методы, использованные для выделения I. multifiliis теронтов и томонтов из воды, предназначены для минимизации загрязнения I. multifiliis микроорганизмом F. columnare и другими бактериями. I. multifiliis томонты собирались отдельно и промывались таким образом, чтобы минимизировать объем воды, переносимой между промываниями. Теронты собирались при помощи центрифугирования и активно промывались в стерильной воде. Не смотря на это, клоны F. columnare представляли 50% последовательностей клонов из препаратов ДНК томонтов или теронтов. EUB338-позитивная бактерия наблюдалась на ресничках теронтов, и скопления DAPI-позитивной внеклеточной бактерии были связаны с ресничками DAPI-окрашенных теронтов и томонтов I. multifiliis. Таким образом, связь F. columnare с I. multifiliis проявляется во внеклеточных взаимодействиях с ресничками и сцеплением со слизью, выделяемой теронтами и томонтами. Так как существует тесная физическая связь Flexibacter columnare с I. multifiliis, возможно, что паразит служит носителем бактерии для рыб, включающих отдельные виды, которые являются восприимчивыми к бактериальной инфекции.
ДНК, использованная для создания данных клонов, выделялись из двух различных штаммов I. multifiliis: G5, проходящий в лаборатории с 1995 года, и G13, недавно выделенный из рыбы в естественной среде обитания. Тем не менее, ДНК, выделенная из G5 томонтов и G13 теронтов, содержала лишь двух эндосимбионтов в относительно равных концентрациях. Это свидетельствует о том, что два данных эндосимбионта являются общими для обнаруженных популяций I. multifiliis и не пропадают даже после длительного содержания в лаборатории.
Физиологическое взаимоотношение между данными эндосимбионтами и I. multifiliis непонятны. Так как не все теронты содержат обнаружимое количество эндосимбионтов, последние не играют существенную роль в поддержании развития инфузории, однако их присутствие также не должно быть чрезвычайно губительно для развития хозяина. Неизвестно, играют ли они роль в патогенезе I. multifiliis или воздействуют ли они на иммунную систему зараженной рыбы.
——
Статья является переводом H. Y. Sun, J. Noe, J. Barber, R. S. Coyne, D. Cassidy-Hanley, T. G. Clark, R. C. Findly, H. W. Dickerson. Endosymbiotic Bacteria in the Parasitic Ciliate Ichthyophthirius multifiliis // APPLIED AND ENVIRONMENTAL MICROBIOLOGY, Dec. 2009, p. 7445–7452, представленной в свободном доступе по адресу — перевод: ncbi.nlm.nih.gov/pmc/articles/PMC2786411/pdf/0850-09.pdf