Описание, касающееся зубного ряда, основывалось на световой микроскопии и просвечивающей электронной микроскопии контрольных серий и на ранее опубликованных данных зубного ряда в ротовой полости H. Bimaculatus (Хьюзейн 1990) и глоточного зубного ряда Данио рерио (Ван дер хейен (Van der heyden) и Хьюзейн 2000). При выращивании (72 часов постэмбрионального периода) и 8.5 дней постэмбрионального развития, образование зубов нижней челюсти H. Bimaculatus проходит в 8 из 9 зубных позиций, обнаруженных на каждой половинке челюсти. Они считались как 1-8 от заднего симфиза.
Полностью развитые глоточные зубы данио рерио состоят из трёх ростро-каудальных зубных рядов, локализованных на всех парных пяти жаберных рогов (жаберный рог V, вентральная часть последней жаберной дуги). В течение экспериментального периода (то есть от 45 часов постэмбрионального периода до 79 часов), у личинок происходило развитие зубов только в вентральном ряде (V). Этот ряд обыкновенно состоит из пяти зубных позиций, которые именуются как позиции 1V до 5V (Ван дер хейен и Хьюзейн 2000), но только первое поколение зубов в позициях 3V, 4V и 5V и их соответствующие приемники развивались до 10 дня постэмбрионального развития.
Развитие нижнечелюстных зубов in vitro у H. Bimaculatus
Появление новых зубных зачатков
Количество нижнечелюстных зубов и зубных зачатков, независимо от их уровня развития, присутствовали в контроле (то есть во время эксплантации) и в культивируемых эксплантах, представленных в таблице 1.
По крайней мере один зубной зачаток присутствовал на каждой половинке нижней челюсти во время эксплантации во всех экспериментах и несколько зубов формировались в течении периода культивирования (свыше пяти новых зачатков в эксплантах образованы к 120 часу постэмбрионального развития и культивировались 7 дней).
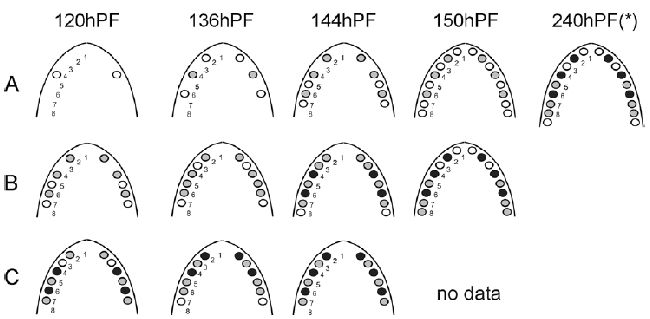
Рисунок 2. H. Bimaculatus. Представлен зубной ряд ротовой полости нескольких уровней онтогенеза во время эксплантации (At0=контроль
in vivo), и спустя трое суток (Bt0+3d) и 7 дней (Ct0+7d) в культуре
in vitro. Представлены уровни наибольшего прорезывания зубов. Положения зубов отсчитываются в ростро-каудальном направлениях; зубной зачаток и зубы представлены кружками (белый – этапы инициирования и морфогенеза, серый – клеточная дифференцировка, черный — прикрепление зуба, hPF – часы постэмбрионального развития, звездочка по Хьюзейну 1990. Заметим, что от более высокой температуры воды в данном эксперименте, чем у Хьюзейна, здесь наблюдалось более ускоренное развитие.
Ряд нижнечелюстных зубов, наблюдаемый in vitro (Рисунок 2B, C), был похож на ситуацию in vivo (Рисунок 2A), то есть первые три зубных зачатка развивались в позиции 4, следующими были позиции 2 и 6; затем шли два зубных зачатка, развивающиеся в позициях 5 и 7; потом зачатки 3 и, в конце, происходил рост зачатков в позициях 1 и 8. Подобным образом происходило становление зубного рядя в экспериментах in vitro (Рисунок 2B, C), когда наблюдалось совпадение инициирования и прикрепления с ситуацией in vivo (сравнение с работой Хьюзейна 1990). В начале прикреплялись зубы в позиции 4, затем происходило, практически совпадающее с in vivo, прикрепление зубов в позиции 2 и 6; и далее по аналогии. Имелось, однако, отставание примерно на 50 часов в развитии зубов in vitro в сравнении с ситуацией in vivo (сравнение, например, с контролем 144 часа постэмбрионального развития с эксплантами 120 часов, которые культивировались 3 суток, то есть возрастом 192 часа; Рисунок 2).
Морфогенез, дифференцировка и прикрепление
Зубные зачатки присутствовали во время эксплантации, и новые зачатки, инициирующиеся после эксплантации, продолжали свое развитие in vitro по схожей картине с экспериментами in vivo (Хьюзейн и Сайр 1997). Например, в 144 часовых образцах зубной зачаток в позиции 3 не присутствовал во время эксплантации (Таблица 1, Рисунок 2A, 3). После 3 дней культивирования зачатки начинали матричное смещение (этап цитодифференцировки) формировались между позициями 4 и меккелевым хрящом (Рисунок 4). После 7 дней формировался толстый слой дентина (Рисунок 5). Зачатки в позиции 6, которые формировались до видимой величины в матриксе в момент эксплантации (144 часа; Таблица 1, Рисунок 2,6), прикреплялись к кости после 3 дней культивирования (Рисунок 7) и были полностью присоединены к 7 дню (Рисунок 8).
Ультраструктура зубных зачатков in vitro
На ультраструктурном уровне проверялась нижняя челюсть 8.5 дневных эксплантов H. Bimaculatus, культивируемых in vitro в течение 7 дней для детализации дальнейшего смещения, in vitro, предентина и прикрепляемой кости. Зуб в позиции 3 был выбран в качестве примера, описанного ниже (Рисунок 9, 10, 11, 12).
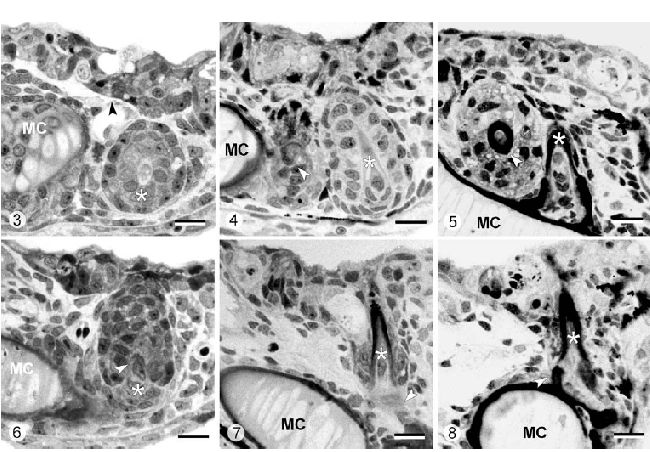
Рисунок 3-8. H. Bimaculatus. Световая микроскопия зуба в позиции 3 (Рисунок 3, 4, 5) и позиции 6 (Рисунок 6, 7, 8) во время эксплантации (время 144 часа постэмбрионального развития, Рисунок 3, 6), после трех дней культивирования (время 3 дня, Рисунок 4, 7), после 7 дней культивирования ( время 7 дней, Рисунок 5, 8)
Рисунок 3. На момент эксплантации зуб в позиции 3 все ещё отсутствует (стрелка), в то время как соседний зуб в позиции 4 (звезда) начинает смещаться матрикс (MC – меккелев хрящ). Калибровка – 10 мкм.
Рисунок 4. После 3 дней культивирования зуб в позиции 3 (стрелка) дифференцируется между зубом в позиции 4 (звезда) и меккелевым хрящом (MC). Калибровка – 10 мкм.
Рисунок 5. Спустя 7 дней культивирования зуб в позиции 3 образовал матрикс in vitro (стрелка), в то время как его сосед в позиции 4 (звезда) продолжает развитие до прикрепленного состояния (MC – меккелев хрящ). Калибровка – 10 мкм.
Рисунок 6. Зуб в позиции 6 (звезда) во время эксплантации (время 144 часа), демонстрирующий начало смещения матрикса (стрелка). MC – меккелев хрящ. Калибровка – 10 мкм.
Рисунок 7. Зуб в позиции 6 (звезда) спустя 3 дня культивирования. Образование матрикса продолжается (срелка вновь формирующаяся кость прикрепления, MC – меккелев хрящ). Калибровка – 10 мкм.
Рисунок 8. Тот же зуб (звезда) спустя 7 дней in vitro. Кость прикрепления (стрелка) сейчас видна (MC – меккелев хрящ). Калибровка – 10 мкм.
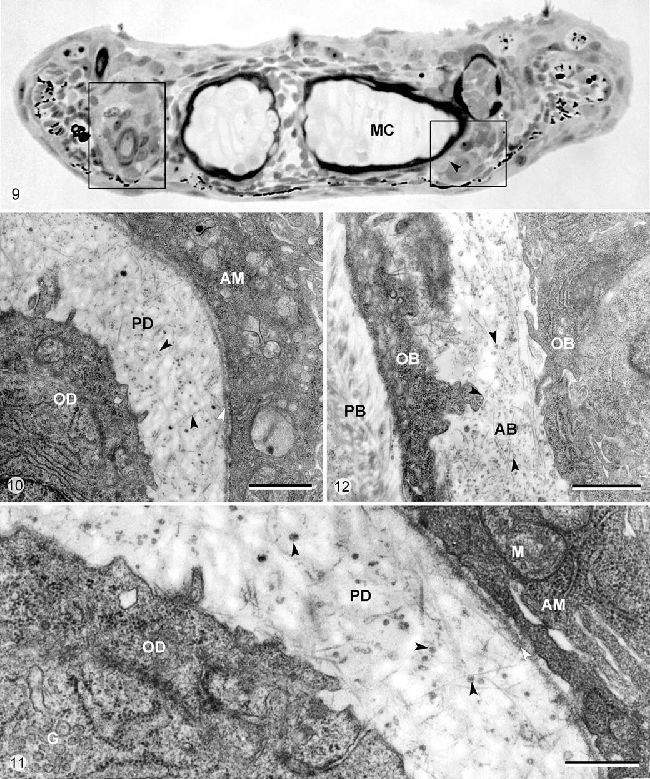
Рисунок 9-12. Микрофотографии световой (Рисунок 9) и просвечивающей электронной микроскопии (Рисунок 10, 11, 12) зубов или зубных зачатков на челюсти головных эксплантов H. Bimaculatus, эксплантированные на 8.5 сутки постэмбрионального развития и культивируемые в течение 7 дней.
Рисунок 9. Развивающийся зуб в положении 3 на двух половинах челюсти. Срезы незначительно наклонены таким образом, что зуб наблюдается как а уровне его перемещения (левая сторона) и его место прикрепления (правая сторона). Стрелка показывает неминерализированную кость прикрепления, формируемую in vitro (MC – меккелев хрящ). Калибровка – 20 мкм.
Рисунок 10. Детали зуба в положении 3, разрезанного по срединной области смещения (левая картинка на Рисунке 9), которая показывает предентин (PD), откладываемый in vitro. Этот матрикс составлен коллагеновыми волокнами (черные стрелки), некоторые из которых заякориваются в зубную пластинку базальной мембраны (белая стрелка).
AM – амелобласт, OD – одонтобласт. Калибровка – 1 мкм.
Рисунок 11. Тот же срез как и на Рисунке 10. Детали одонтобластов (OD) и амелобластов (AM), окруженных предентином (PD), формирующимся in vitro (черные стрелки – сосуды матрикса, белая стрелка – зубная пластинка базальной мембраны, G – область Гольджи, M — митохондрии). Калибровка – 0.5 мкм.
Рисунок 12. Срез через область прикрепления зуба в положении 3 (правая сторона Рисунка 9). Детали (неминерализованной) матрикса кости прикрепления (AB), формируемого in vitro и окруженного остеобластами (OB). Стрелки – показывают сосуды матрикса (PB – перихондральная кость, окружающая меккелев хрящ). Калибровка – 1 мкм.
Предентин отложенного матрикса in vitro содержали тонкие коллагеновые фибриллы, беспорядочно разбросанные в матриксе (Рисунок 10). Несколько из них заякоривались в зубную пластинку базальной мембраны, выстилающей поверхность амелобластного матрикса. Многочисленные электроноплотные структуры, которые имели средний диаметр 5 нм и были окружены мембраной и, которые вероятно являлись везикулами матрикса, распределялись в нем (Рисунок 11). Короткие одонтобластные тяжи проникали в предентин (Рисунок 10,11). Как одонтобласты, так и амелобласты показали нормальное состояние (Рисунок 11). Зрелые одонтобласты обладали свойствами активно секретирующих клеток, индикатором этого служили хорошо развитый эндоплазматический ретикулюм, выраженный аппарат Гольджи и секреторные гранулы (Рисунок 10, 11). Амелобласты также содержали выделяющиеся области Гольджи и несколько митохондрий, и были связаны друг с другом за счет пальцевидных выростов (Рисунок 10, 11). Матрикс прикрепляемой кости, отложенный in vitro, имел сходство с матриксом предентина, от которого можно было выделить только большое количество матричных везикул и отсутствие базальной прослойки между матриксом и выстилающих клеток (Рисунок 12). Большие округлые секреторные остеобласты в пульповых одонтобластов блицовывали кость прикрепления, когда как на противоположность стороне матрикс прикрепляемой кости был отделен от перихондральной кости, окруженной меккелевым хрящом за счет слоя остеобластов.
It vitro развитие глоточных зубов у Данио рерио
Возникновение новых зубных зачатков
У контрольных личинок на 45 часе постэмбрионального развития (то есть несколько часов перед выращиванием) и 48 часе (то есть во время выращивания), только один зубной зачаток присутствует на каждой стороне в позиции 4V (Рисунок 13A). Через 3 дня культивирования данный зачаток развивался дальше возникал один или чаще два новых зачатка в позиции 3V и 5V, соответственно (Рисунок 13B).
У контрольных личинок на 55 часе постэмбрионального развития, присутствует 2 (и в некоторых случаях 3) зубных зачатка: хорошо развитый зубной зачаток в позиции 4V и менее развитые зачатки в позиции 3V и 5V. Спустя трое суток культивирования, присутствует 3 зуба: прикрепленный зуб в позиции 4V и два хорошо дифференцированные зачатки в позициях 3V и 5V (Рисунок 13B).
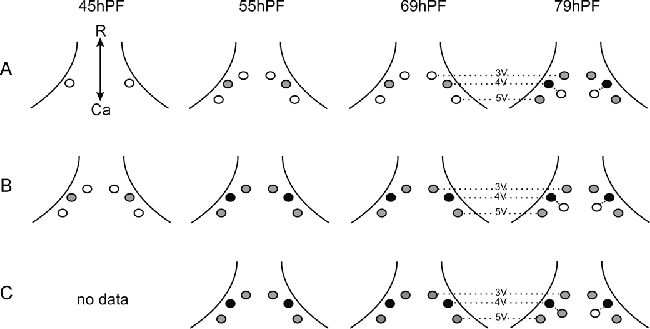
Рисунок 13. D. rerio. Представлен наблюдаемый зубной ряд нескольких уровней онтогенеза во время эксплантации (At0=контроль
in vivo), и спустя трое суток (Bt0+3d) и 7 дней (Ct0+7d) в культуре
in vitro. Представлены уровни наибольшего прорезывания зубов. Небольшие индивидуальные различия и отличия слева направо иногда присутствовали (внутренняя линия глоточной челюсти, когда пятый жаберный рог не был ещё дифференцирован на 48 часе и у молодых животных). Зубные зачатки и зубы представлены кружками (белый, серый, черный отличаются уровнями развития, Рисунок 2). Штрихпунктирная линия позиций зубов 3V, 4V и 5V, Ca – каудально, R – рострально.
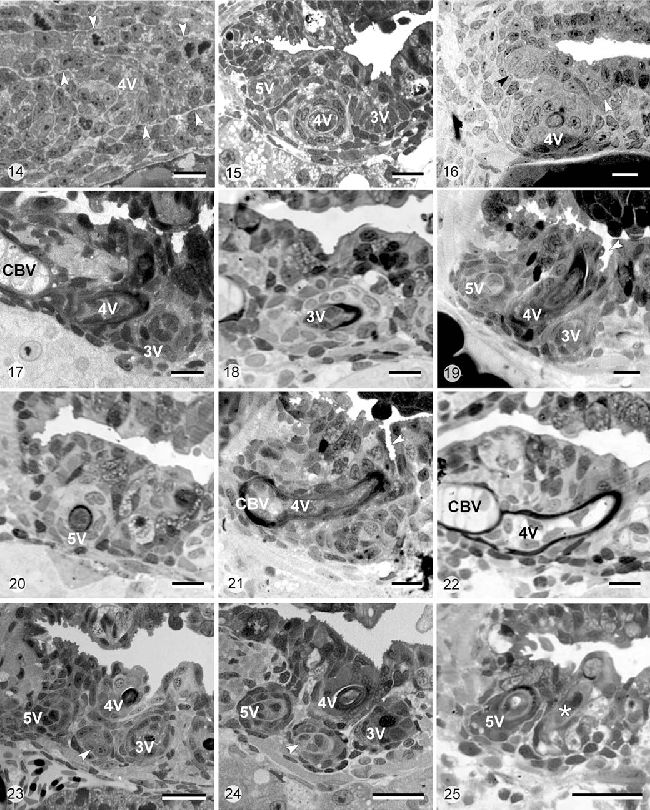
Рисунок 14-15. D. rerio. Световая микроскопия одной стороны прорезывания глоточных зубов во время эксплантации (t0=45 час постэмбрионального развития, Рисунок 14) и спустя трое суток культивирования (t0+3d, Рисунок 15)
Рисунок 14. Глоточный эпителий во время эксплантации. Представлен только зуб в позиции 4V на этапе морфогенеза. Глоточная полость ещё не открыта (белые стрелки – граница между глоточным эпителием и окружающей мезенхимой, то есть позиция базальной мембраны). Калибровка 10 мкм.
Рисунок 15. Спустя трое суток in vitro, зуб в позиции 4V находился в стадии клеточной дифференцировки, показано начало продукции матрикса. Зубы в позиции 3V и 5V явно присутствуют, оба находятся на стадии морфогенеза. Отмечены поляризованные клетки эмалевого органа (будущие амелобласты) зуба в позиции 3V. Глоточная полость открыта in vitro. Калибровка 10 мкм.
Рисунок 16-22. D. rerio. Световая микроскопия одной стороны прорезывания глоточных зубов во время эксплантации (t0=55 часов постэмбрионального развития, Рисунок 16), спустя трое суток культивирования (t0+3d, Рисунок 17, 19, 21) и спустя 7 дней культивирования (t0+7d, Рисунок 18, 20, 22).
Рисунок 16. Во время эксплантации зубной зачаток в позиции 4V находится на этапе клеточной дифференцировки, в то время как незначительная постройка эпителия является индикатором начала формирования зубного зачатка в позиции 3V (белая стрелка) и 5V (черная стрелка). Калибровка 10 мкм.
Рисунок 17. Зубной зачаток в позиции 3V доходит до уровня клеточной дифференцировки спустя трое суток культивирования. Как и in vivo, зачаток развивается медиально от зуба в позиции 4V (CBV – хрящ V жаберного рога). Калибровка 10 мкм.
Рисунок 18. Спустя 7 суток культивирования, зубной зачаток в позиции 3V формировал видимое количество матрикса. Калибровка 10 мкм.
Рисунок 19. Зубной зачаток в позиции 5V следует по общей траектории развития с зубным зачатком 3V (4V зубной зачаток 4V). Спустя трое суток культивирования, он достигал этапа клеточной дифференцировки. Отмечено присутствие эпителиальных крипт, которые появлялись in vitro (белая стрелка). Калибровка 10 мкм.
Рисунок 20. Спустя 7 дней культивирования, зубной зачаток в позиции 5V откладывал выраженное количество матрикса. Калибровка 10 мкм.
Рисунок 21. Зуб в позиции 4V, который начал откладывать матрикс на момент эксплантации (перенесен Рисунок 16), прикреплялся после 3 дней культивирования на перихондральную кость, окружающую хрящ V жаберного рога (CBV). Белая стрелка показывает крипту, которая сформировалась in vitro. Калибровка 10 мкм.
Рисунок 22. Зуб в позиции 4V прикреплялся к 7 дню in vitro; не наблюдалось признаков нарушения (CBV — хрящ V жаберного рога). Калибровка 10 мкм.
Рисунок 23-25. D. rerio. Световая микроскопия одной стороны прорезывания глоточных зубов во время эксплантации (t0=79 часов постэмбрионального развития, Рисунок 23), спустя трое суток культивирования (t0+3d, Рисунок 24) и после 7 дней культивирования (t0+7d, Рисунок 25)
Рисунок 23. Четвертый зубной зачаток (белая стрелка), первая смена зуба в позиции 4V, к 79 часам постэмбрионального развития они присутствуют как вздутия эпителия. Зубные зачатки присутствовали в позициях 3V, 4V и 5V. Калибровка 10 мкм.
Рисунок 24. Данный четвертый зубной зачаток подвергался морфогенезу после 3 дней культивирования (белая стрелка). Как и in vivo, этот зубной зачаток находился на вентрально от зуба в позиции 4V и фланкировался зубными зачатками в позициях 3V и 5V. Калибровка 10 мкм.
Рисунок 25. Смененный зубной зачаток (звезда) подвергался клеточной дифференцировки после 7 дней культивирования и в нём присутствовало приличное количество матрикса. Зубной зачаток находился латерально от зачатка в позиции 5V. Калибровка 10 мкм.
Спустя 7 дней культивирования, не образовывалось новое количество зубных зачатков, но три присутствующих зуба развивались дальше (Рисунок 13C).
В контроле 69 часов постэмбрионального развития три зубных зачатка ясно выделялись в позициях 4V, 3V и 5V. В эксплантах, взятых при 69 часах и развивающихся in vitro в течение 3 и 7 дней, не обазовывалось новых зачатков и только три продолжали развиваться (Рисунок 13B, C).
У 79 часовых личинок ясно различалось 4 зачатка, старейший из которых (позиция 4V) был прикреплен, а младший (приемник в позиции 4V) просто выпячивался из эпителия (Рисунок 13A). У эксплантов 3 и 7 дней развития in vitro не создавалось новых зачатков, тем не менее младший зачаток в позиции 4V продолжал развитие (Рисунок 13B, C). Обобщая, можно сказать, что формирование зубного ряда in vitro проходит подобно in vivo, то есть в начале 4V, затем почти по схоже тенденции следуют 3V и 5V, а потом приемник в позиции 4V. Развитие зуба in vitro все таки отсрочено по сравнению с одонтогенезом in vivo, наблюдаемого у H. bimaculatius, то есть примерно 50-60 часов.
Морфогенез, дифференцировка и прикрепление
К 45 часам постэмбрионального развития присутствовал только зачаток в позиции 4V и он находился в фазе морфогенеза: эпителий имел явные инвагинации и формировал колоколообразный эмалевый орган, окружающий маленькое количество мезенхимальных клеток (Рисунок 14). Эпителий, смежный с данным зачатком (то есть точкой развития будущих зачатков в позиции 3V и 5V), не демонстрировал факта дифференцировки. Спустя трое суток культивирования, глоточная полость открывалась и три зубных зачатка ясно прослеживались: зубной зачаток в позиции 4V, с маленьким и обособленным количеством матрикса, и зачатки в позиции 3V и 5V, оба на этапе морфогенеза (Рисунок 15). Таким образом, зачатки, отсутствующие во время эксплантации (или, по крайней мере, морфологически неразличимы), развивались in vitro, но, возможно потому, что экспериментальное время было ограничено (не один из этих зачатков не культивировался до 7 дней), достигался только этап морфогенеза.
Когда экспланты создавались немного позже (t0=55 часов постэмбрионального развития), присутствовало 2 или 3 зачатка: зубной зачаток в позиции 4V с маленьким, но обособленным количеством матрикса, и зачатки в позициях 3V и 5V (Рисунок 16). Небольшие вздутия эпителия от этих двух областей показывают, что данные зачатки все ещё находятся в фазе инициации и имеют трудности со вступлением на этап морфогенеза (Рисунок 16). Дальнейшее развитие зачатков в позиции 3V и 5V проходит параллельно. Спустя трое суток культивирования, зачаток в позиции 3V демонстрировал начало отложение матрикса (Рисунок 17) и значительное количество последнего образовывалось через 7 суток культивирования (Рисунок 18). Подобным образом, зачаток в позиции 5V переходил на стадию клеточной дифференцировки после 3 дней культивирования (Рисунок 19). К 7 дню культивирования он имел обособленное количество матрикса (Рисунок 20). Таким образом, зачатки, которые были на этапе инициации на момент эксплантации подвергались морфогенезу и клеточной дифференцировки за период в 7 дней in vitro.
С другой стороны, зачатки, откладывающие матрикс во время эксплантации (зуб в позиции 4V, Рисунок 17), заканчивали прикрепление in vitro менее, чем за 3 дня (Рисунок 21). Данная ситуация не изменялась после 7 дней культивирования in vitro (Рисунок 22). Не смотря на обнаруженные крипты (Рисунок 19, 21), зуб в положении 4V не прорезывался. Подобным образом в условиях in vivo, зуб 4V полностью анкилозировался к перихондральной кости, окружающей хрящ V жаберного рога, без вовлечения костной пластинки (apolamellae). В противоположность этому, зубы в положениях 3V и 5V экплантировались прежде, чем начиналось образование матрикса, не прикреплялись, даже спустя 7 дней культивирования. In vivo, зачатки в положениях 3V и 5V прикреплялись к 144 часам (Ван дер хейен (Van der heyden) и Хьюзейн 2000). Также рассмотренная отсрочка примерно 50 часов приписывалась эксперимантам in vitro, зачатки 3V и 5V, эксплантировались к 55 часам, а в теории имелось значительное время прикрепления после 7 дней культивирования.
Наконец, четвертый зубной зачаток, локализованный вентрально от функционального зуба в положении 4V, был на этапе морфогенеза, когда головы эксплантировались 79 часа постэмбрионального развития (Рисунок 23). Данный зачаток, являющийся первой заменой зуба в позиции 4V, демонстрировал начало отложения матрикса после 3 дней культивирования (Рисунок 24) и был хорошо дифференцирован к 7 дням (Рисунок 25). При текущих экспериментальных ограничениях времени, с максимумом культивирования 7 дней, не один зачаток не подвергался полному процессу морфогенетической инициации, морфогенезу, дифференцировки и прикреплению in vitro.
Ультраструктура формирующихся зубов in vitro
В контрольных образцах 69 часов постэмбрионального развития зачатки 3V и 4V рассматривались на отдельных поперечных срезах (Рисунок 26). Зубной зачаток в положении 3V находился на этапе морфогенеза (Рисунок 26, 29) с зубным сосочком, окруженным зубным эпителием. Как клетки зубного сосочка (преодонтобласты), так и клетки внутреннего зубного эпителия (преамелобласты) были ещё недифференцированы. Зачаток в положении 4V формировал тонкий слой дентин-подобного матрикса (Рисунок 26, 30). Клетки сосочка зуба и клетки внутреннего зубного эпителия явно дифференцировались в секреторные одонтобласты и амелобласты, соответственно. Оба типа клеток характеризовались присутствием множества митохондрий и цитоплазмы с эндоплазматическим ретикулюмом (ЭПР). Матрикс начинал минерализоваться. Частицы кристаллов проявлялись как кластеры вдоль дентинных коллагеновых волокон. Базальная пластинка находилась между амелобластами, и поверхность дентина нельзя было полностью выделить.
Головы экплантировались на 69 часов постэмбрионального развития и брались в культуру на 3 дня (Рисунок 27, 31, 32), зуб в положении 4V прикреплялся и зуб в положении 3V находился на уровне клеточной дифференцировки (Рисунок 27). Вновь отложенный матрикс зубом 3V не был минерализован и состоял из коллагеновых волокон, которые ориентировались параллельно к поверхности зуба (рисунок 31). Одонтобласты вмещали большое количество ЭПР и демонстрировали заметные цитоплазматические тяжи, которые простирались через предентин-подобный матрикс. Базальная пластинка ещё присутствовала между поверхностью матрикса и внутренним зубным эпителием.
Не смотря на то, что кончик зуба в положении 4V хорошо минерализовался, минерализация не проходила вниз к основанию кости прикрепления (Рисунок 27) . Неминерализованный матрикс формировался in vitro, в то время как кончик зуба минерализовался при эксплантации (рисунок 27, 32). Одонтобласты находились в секреторной фазе, что подтверждалось наполнением ими гранул ЭПР (Рисунок 32). Матрикс предентина, формирующийся in vitro, состоял из плотно упакованных коллагеновых волокон, следующих за горизонтальной осью зубы (Рисунок 32).
В контрольных образцах, фиксированных на 6 днях постэмбрионального развития (то есть примерно схожее время 69 часовых эксплантов, культивируемых 3 дня), зубы в положении 3Vпоказывали тонкий слой матрикса, который был частично минерализован (Рисунок 28, 33). Слой плотно упакованных коллагеновых волокон составлял матрикс предентина, окаймляющего поверхность одонтобласта. Рядом с фронтом минерализации кристаллы скапливались около коллагеновых волокон. Одонтобласты, которые откладывали матрикс дентина были высоко дифференцированы с цитоплазмой, заполненной цистернами ЭПР и, содержащими многочисленные митохондрии. В противоположность минерализованному дентину и выделяемым внутренним зубным эпителиальным клеткам, базальный слой не был сильно выражен (Рисунок 33). Внешний (дентин) слой зуба в положении 4V был хорошо минерализован, в то время как внутренняя сторона зуба, облицовывающая пульповую полость, окаймлялась за счет неминерализованного предентинового слоя 1 мкм толщиной (Рисунок 28, 34). Зуб в положении 4V прикреплялся несколько дней и его зубной сосочек показался типично (Рисунок 28). Клетки зубного сосочка ещё имели маленькое количество ЭПР. Кристаллы залегали вдоль плотноупакованных коллагеновых волокон. Базальная пластинка отсутствовала. Внутренние клетки зубного эпителия были сплюснутыми и тесно граничили друг с другом.
Изолированные глоточные челюсти взрослых, культивирующиеся in vitro, показали обычное состояние и хорошо представленные структуры, что демонстрировало пригодность технологии in vitro в инкубации изолированных взрослых органов. Мы обнаружили свидетельства то, что прикрепление зубов продолжается in vitro до момента предшествующего эксплантации (данные не показаны).
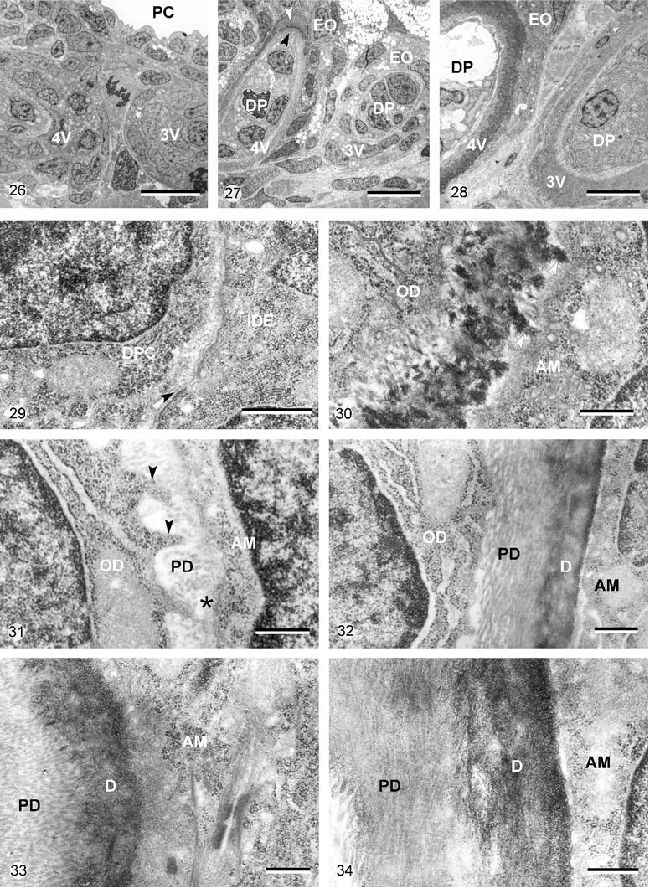
Рисунок 26-34. Микрофотографии просвечивающей электронной микроскопии, на которых изображены зубные зачатки Д. рерио в положении 3V и 4V в контроле 69 часов постэмбрионального развития (Рисунок 26, 29, 30), в образцах, эксплантированных на 69 часу постэмбрионального развития и культивируемых в течение 3 дней (Рисунок 27, 31, 32) и в контрольных образцах на момент эксплантационной фиксации, то есть 6 дней постэмбрионального развития (Рисунок 28, 33, 34).
Рисунок 26. Зубной зачаток в положении 3V и 4V на момент эксплантации. Зубной зачаток 4V производит небольшое количество матрикса. PC – глоточная полость. Калибровка – 10 мкм.
Рисунок 27. Основной обзор зачатка в положении 3V и 4V на 6 дне постэмбрионального развития in vivo. В обоих зубах матрикс дентина минерализован. DP – зубной сосочек; EO – эмалевый орган. Калибровка – 5 мкм.
Рисунок 29. Детали зубного зачатка в позиции 3V, показанного на Рисунке 26. Клетки зубного сосочка (DPC) и внутренние клетки зубного эпителия (IDE) недифференцированны и обособленны за счет базальной пластинки (стрелка). Калибровка – 1 мкм.
Рисунок 30. Детали кончика зуба в положении 4V, показанного на Рисунке 26. Одонтобласты (OD) дифференцировались и формировали заметное количество дентин-подобного матрикса, который минерализовался. Обособленные участки минеральных кристаллов (стрелки) простирались до поверхности амелобласта (AM). Базальная мембрана не была сильно различима. Калибровка – 1 мкм.
Рисунок 31. Детали матрикса зубного зачатка в позиции 3V (показан на Рисунке 27). Тонкий слой предентина (PD) формировался in vitro. Одонтобластические процессы (стрелки) проходили в матриксе предентина. Пластинка базальной мембраны ещё присутствует (звезда), покрывая поверхность амелобласта (AM).
OD – однонтобласты. Калибровка – 0.5 мкм.
Рисунок 32. Детали предентина (PD) и дентина (D) зуба в положении 4V (показан на Рисунке 27). Предентин состоит из плотноупакованных коллагеновых волокон, параллельных поверхности зуба. Коллагеновые волокна не сильно выражены в минерализованном дентине, который формировался in vivo перед эксплантацией. AM – амелобласт, OD – одонтобласт. Калибровка – 0.5 мкм.
Рисунок 33. Зуб в положении 3V (показан на Рисунке 28) формировал большое количество предентина (PD) и дентина (D). Базальная мембрана, покрывающая поверхность амелобласта (AM), не сильно видна. Калибровка – 0.5 мкм.
Рисунок 34. Зуб в положении 4V (показан на Рисунке 28). Одонтобласты и амелобласты (AM) обособленны друг от друга за счет рассмотренных слоев предентина (PD) и минерализованного дентина (D). Калибровка – 0.5 мкм.
———
Данный текст является переводом статьи Tooth development in vitro in two teleost fish, the cichlid Hemichromis bimaculatus and the cyprinid Danio rerio. авторов C. Van der heyden . F. Allizard . J.-Y. Sire . A. Huysseune. Cell Tissue Res (2005) 321: 375–389. Опубликованном в сети: 21 June 2005.
Рассказ идет от первого лица, так как это представлено в оригинале.