В статье описано исследование, которое сравнивает степень метаболизма гуппи, Poecilia reticulate (Poecilidae) и черной моллинезии, Poecilia latipinna (Poecilidae) при температуре 23-25 °C и 15 °C с использованием непрямой респирометрии. Большинство аквариумных видов рыбок содержаться при температуре 23-25 °C. Отметка 15 °C была выбрана для проверки выживаемости рыбок в более низкой температуре и, одновременно, для сравнения метаболизма двух видов живородящих. Гуппи и моллинезии являются мелкими очень популярными аквариумными живородящими видами. Первые населяют пресные воды Венесуэлы и острова Карибского моря, в которых температура обычно составляет 20 °C . Вторые обитают между Мексикой и Венесуэлой и являются особенно чувствительными к холодной воде. Самцы гуппи достигают около 3 см в длину и в естественных условиях мельче, чем самцы моллинезии. При использовании титрования до конечной точки измерялся уровень метаболитического диоксида углерода (CO2), производимого гуппи и черной моллинезией. Размер их тела был такой, что гуппи вытесняли — 1 мл, а моли — 2 мл воды. Данные собирались и пересчитывались в виде M CO2/мл/ч.
Средний уровень метаболизма гуппи составлял 7,11; 10,45; 11,58 и 9,02 мкM CO2/мл/ч при температуре 15, 23, 24 и 25 °C , соответственно. Черная моллинезия при данных температурах имела уровень метаболизма – 4,78; 6,6; 7,40 и 5,78 мкM CO2/мл/ч, соответственно. Оба вида выдержали испытания при температуре 15 °C . Однако у черной моллинезии очень незначительно изменялся метаболизм (с 5,4 до 4,5 мкM CO2/мл/ч), чем у гуппи (8,0 до 6,3 мкM CO2/мл/ч). Две группы отвечали изменением метаболизма на колебания температуры. Неясно, являются ли наблюдаемые различия видовой особенностью, либо они зависят от массы тела. Для ответа на него необходимо провести аналогичное исследование, избрав в качестве испытуемых 6 см гуппи и моллинезий схожего размера. Подобно другим жабродышащим животным, моллинезия и гуппи непрерывно выделяют углекислый газ в окружающую среду. Большинство видов, в частности акул и скатов, развило механизмы проточного пассивного дыхания (Muir and Kendall, 1968; Eckert and Randall, 1983) или щечного дыхания (Steffensen and Lambolt, 1983; Steffensen, 1985). Кроме того, некоторые рыбки могут переключаться между двумя способами дыхания. Steffensen (1985) продемонстрировал вовлеченность как хеморецепторов, так и механорецепторов в рефлексе переключения способа дыхания. На клеточном уровне, кислород используется в качечестве акцептора электронов во время аэробного дыхания. В результате производится энергия, метаболитический диоксид углерода и вода (Pelster and Driedzic, 1994; Pelster, 1995a, 1995b; Pelster and Port, 1996). Степень продукции двуокиси зависит от комплекции особи, её активности и температуры. Данные факторы также влияют на уровень потребляемого кислорода (Hughes, 1965).
Материалы и методы
Три 40 литровые аквариума наполнялись нехлорированной водой, в которые затем помещались гуппи и черные моллинезии. Каждая гуппи подбиралась таким образом, чтобы вытеснить 1 мл градуированного цилиндра, в то время как черные молли вытесняли 2 мл. Вода в аквариуме постоянно аэрировалась и фильтровалась. Перед проведением экспериментов животных оставляли на 2 недели для акклиматизации (Hochachaka and Somero, 1971). Кормление осуществлялось единожды в день хлопьями. Для эксперимента брались 3 мензурки по 100 мл (1, 2 и 3), в которые наливалось 50 мл воды температурой 23 °C . Черную молли и гуппи вылавливали из соответствующего аквариума и помещали в мензурки 3 и 2, соответственно. При этом 1 мензурка использовалась как контроль. Каждая емкость плотно закрывалась чистой пластиковой крышкой и резиновой лентой. В течение 30 минут рыбок оставляли в покое, и они которого проявляли свою обычную активность. Затем быстро откупоривали крышку и пересаживали рыбок в перфорированные пластиковые садки 50 мл мерных цилиндров. Последние содержали 20 мл воды, взятой из соответствующих исходных аквариумов. Избегали загрязнения или потери воды в мензурках во время пересадки рыбок с помощью специального перфорированного пластикового садка для каждой особи, воду из которого затем полностью возвращали в мензурку.
В качестве индикатора в воду вносилось 8 капель раствора фенолфталеина. Тест воды производился при помощи титрования до конечной точки с бюреткой, которая содержала 2,5 мкМ раствора NaOH. Количество щелочи, использованное для нейтрализации угольной кислоты в контроле высчитывалось из количества, использованного для мензурок 2 и 3. В конечных результатах приводятся соответствующие объемы NAOH, затраченные на титрование мензурок 2 и 3,в которых ранее находились рыбки. Масса рыбки определялась как разница между исходным объемом мерного цилиндра 50 мл и конечного объема. Описанные процедуры повторялись при температурах 24, 25 и 15 °C , между процедурами рыбкам давали отдых на 24 часа. Уровень метаболизма вычислялся по формуле – [mR – мл затраченного NAOH] х [2,5мкM NaOH/мл]/[Объем рыбки (мл)] х 0,5 ч.
Результаты
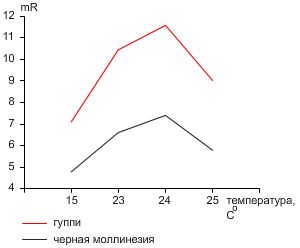 Рисунок 1. Уровень метаболизма (mR) гуппи и черной молли.Уровень метаболизма (mR) черной молли при 23-25 °C колебался в диапазоне 5,0-14,3 мкM CO2/мл/ч (Таблица 1). Для гуппи при данных температурах mR – составлял 9,0-13,5 мкM CO2/мл/ч (Таблица 1). Средний mR гуппи составлял 10,45; 11,58 и 9,02 мкM CO2/мл/ч при 23,24 и 25 °C , соответственно (Таблица 2). Для сравнения, средний mR молли при данных температурах – 6,6; 7,40 и 5,78 мкM CO2/мл/ч, соответственно. При 15 °C mR молли колебался в диапазоне 4,5-5,4 мкM CO2/мл/ч, а гуппи – 6,3-8,0 мкM CO2/мл/ч (Таблица 3). Уровень метаболизма для обоих видов был минимальным при 15 °C и максимальным при 24 °C . Для всех температур не наблюдалась случаев гибели рыбок.
Рисунок 1. Уровень метаболизма (mR) гуппи и черной молли.Уровень метаболизма (mR) черной молли при 23-25 °C колебался в диапазоне 5,0-14,3 мкM CO2/мл/ч (Таблица 1). Для гуппи при данных температурах mR – составлял 9,0-13,5 мкM CO2/мл/ч (Таблица 1). Средний mR гуппи составлял 10,45; 11,58 и 9,02 мкM CO2/мл/ч при 23,24 и 25 °C , соответственно (Таблица 2). Для сравнения, средний mR молли при данных температурах – 6,6; 7,40 и 5,78 мкM CO2/мл/ч, соответственно. При 15 °C mR молли колебался в диапазоне 4,5-5,4 мкM CO2/мл/ч, а гуппи – 6,3-8,0 мкM CO2/мл/ч (Таблица 3). Уровень метаболизма для обоих видов был минимальным при 15 °C и максимальным при 24 °C . Для всех температур не наблюдалась случаев гибели рыбок.
| № | Температура, °C | 2.5 мкM раствора NaOH(мл) | Объем | Произведенный CO2 (мкM/мл/ч) | ||||
| Gu | Bm | Контроль | Gu | Bm | Gu | Bm | ||
| 1 | 23 | 2,40 | 3,40 | 0,20 | 2,20 | 3,20 | 11,00 | 8,00 |
| 2 | 23 | 2,20 | 2,40 | 0,40 | 1,80 | 2,00 | 9,00 | 5,00 |
| 3 | 23 | 2,50 | 2,70 | 0,40 | 2,10 | 2,30 | 11,50 | 5,57 |
| 4 | 23 | 2,60 | 2,50 | 0,45 | 2,15 | 2,05 | 10,75 | 5,13 |
| 5 | 23 | 2,40 | 3,40 | 0,40 | 2,00 | 3,00 | 10,00 | 7,50 |
| 6 | 24 | 3,00 | 6,00 | 0,30 | 2,70 | 5,70 | 13,50 | 14,30 |
| 7 | 24 | 3,00 | 2,80 | 0,55 | 2,45 | 2,25 | 12,30 | 5,63 |
| 8 | 24 | 2,50 | 3,75 | 0,45 | 2,05 | 3,30 | 10,30 | 8,25 |
| 9 | 24 | 2,70 | 2,80 | 0,40 | 2,30 | 2,40 | 11,50 | 6,00 |
| 10 | 24 | 2,65 | 3,75 | 0,50 | 2,15 | 3,25 | 10,80 | 8,13 |
| 11 | 25 | 2,85 | 3,15 | 0,45 | 2,40 | 2,70 | 12,00 | 6,75 |
| 12 | 25 | 2,70 | 4,00 | 0,45 | 2,25 | 3,55 | 11,30 | 8,88 |
| 13 | 25 | 2,50 | 3,00 | 0,45 | 2,05 | 2,55 | 10,30 | 6,38 |
| 14 | 25 | 2,80 | 3,20 | 0,45 | 2,35 | 2,75 | 11,75 | 6,88 |
| 15 | 25 | 2,60 | 3,60 | 0,45 | 2,25 | 3,15 | 10,80 | 7,90 |
Таблица 1. Уровень метаболизма Poecilia reticulata и Poecilia latipinna, основанное на продукции CO2 при 23-24 °C.
| Рыбка | 15 °C | 23 0C | 24 °C | 25 °C |
| Гуппи | 7,11 | 10,45 | 11,55 | 9,02 |
| Черная моллинезия | 4,78 | 6,60 | 7,40 | 5,78 |
Таблица 2. Уровень метаболизма Poecilia reticulata и Poecilia latipinna, основанное на продукции CO2 в мкM/мл/ч.
| № | 2.5 мкM раствора NaOH(мл) | Объем | Произведенный CO2 (мкM/мл/ч) | ||||
| Gu | Bm | Контроль | Gu | Bm | Gu | Bm | |
| 1 | 1,90 | 2,45 | 0,30 | 1,60 | 2,15 | 8,00 | 5,40 |
| 2 | 1,60 | 2,10 | 0,30 | 1,30 | 1,80 | 6,50 | 4,50 |
| 3 | 1,50 | 2,10 | 0,25 | 1,25 | 1,85 | 6,30 | 4,60 |
| 4 | 1,65 | 2,15 | 0,35 | 1,30 | 1,80 | 6,50 | 4,50 |
| 5 | 1,75 | 2,25 | 0,35 | 1,40 | 1,90 | 7,00 | 4,80 |
| 6 | 2,05 | 2,30 | 0,45 | 1,60 | 1,85 | 8,00 | 4,60 |
| 7 | 1,75 | 2,25 | 0,45 | 1,30 | 1,80 | 6,50 | 4,50 |
| 8 | 2,00 | 2,45 | 0,40 | 1,60 | 2,05 | 8,00 | 5,10 |
| 9 | 1,85 | 2,40 | 0,40 | 1,45 | 2,00 | 7,30 | 5,00 |
| 10 | 1,75 | 2,25 | 0,35 | 1,40 | 1,90 | 7,00 | 4,80 |
Таблица 3. Уровень метаболизма Poecilia reticulata и Poecilia latipinna, основанное на продукции CO2 при 15 °C.
Обсуждение
В отсутствии высокотехнологичного оборудования, непрямая респирометрия является недорогим и эффективным способом измерения уровня метаболизма водных животных. mR обоих видов возрастал с увеличением температуры. Однако рост не был бесконечным, и при 25 °C наблюдался спад mR по сравнению с 24 °C (Рисунок 1). Понижение метаболизма свидетельствует о том, что гуппи и черная молли имеют верхнюю планку температурной терпимости для проявления присущей им активности. В частности, когда наблюдается оптимальный уровень метаболизма, рыбки плавают непрерывно, без проявления тревожности и утомления (Hughes, 1965; Fry, 1971; Milligan, 1996). Такое плавание также называется устойчивым состоянием и включает широкий диапазон скоростей перемещения (Milligan, 1996), что и наблюдается в большинстве домашних аквариумов. Устойчивый оптимальный уровень метаболизма крайне важен для нормального перемещения рыбок на дальние расстояния, для их жизнеспособности, и он обеспечивается, главным образом, за счет аэробного окисления в красных мышечных волокнах. В данном случае, молекулы пирувата метаболизируются в митохондриях до CO2 и H2O за счет кислорода, который является конечным акцептором электронов.
Черная моллинезия была вдвое больше гуппи. В свою очередь, последние демонстрировали более высокий уровень метаболизма при различных температурах. Это наблюдение свидетельствует о том, что более мелкие животные проявляют более высокий уровень метаболизма (Hughes, 1965). Черная моллинезия имела большую восприимчивость к холодной температуре (15 °C), что проявлялось в незначительном смещении метаболизма (4,5-5,4), в то время как у гуппи — 6,3-8,0.
——
Исследование проводилось с октября 1997 по апрель 2000 год в Государственном университете «Велли» Миссиссипи, город Итта Бена.
Julius O. Ikenga, Sharonda R. Stewart, Benita L. Page. Comparison of Metabolic Rates of Guppy, Poecilia reticulata (Poecilidae), and Black Molly, Poecilia latipinna (Poecilidae), at Different Temperatures.// Journal of the Mississippi Academy of Sciences, July, 2001
источник: findarticles.com/p/articles/mi_hb3039/is_3_46/ai_n28852980/