Большие успехи в практике аквакультивирования достигаются путем расширения площади угодий, технологического прорыва в области искусственного разведения, выращивания личинок, разработанной рецептуре кормления и интенсификации развития обслуживающих систем. Тем не менее, с развитием рыборазводческой сферы отрее встает вопрос об эффективном лечении культивируемых видов.
Контроль инфекции при помощи антибиотиков показывает хорошие результаты, однако в тканях рыбы накапливаются токсичные вещества. Кроме того, развивающаяся у бактерий сопротивляемость к антибиотикам и перенос гена сопротивляемости заставляет фермеров отказаться от их использования. Альтернативой служит проведение вакцинации рыбок.
Основной целью вакцинации является повышение иммунитета животного, а также распознавание им патогенных организмов (антигенов), что в итоге снижает тяжесть заболевания. Механизм действия вакцины основан на распознавании или взаимодействии иммуноглобулинов вакцины с компонентом вакцины (неактивным патогенном). Таким образом, основной задачей является вовлечение в процесс специфических систем иммунитета.
Вакцинация выполняется тремя путями:
1. Инъекция;
2. Погружение в раствор;
3. Орально.
Оральное введение представляется самым дешевым и эффективным способом, пригодным в рыборазводческой сфере. Он может использовать мертвые антигены, бактериальных призраков, субъединичные или ослабленные вакцины, которые распространены в настоящее время. Среди всех способов борьбы, тепловое воздействие и введение ослабленной вакцины часто приводит к изменению антигенного участка или эпитопа (часть макромолекулы антигена, которая распознаётся иммунной системой) [7]. В свою очередь, использование субъединичной вакцины является заменой теплового воздействие и ослабленной вакцины и предполагает инъецирование животным лишь единичного гена патогенного микроорганизма, который индуцируют выработку антител. Однако её применение в аквакультуре ораничивается слабыми иммуногенными свойствами и тем, что не которые животные, не подверженны действию патогенной части в своем естественном состоянии. В данном случае единственной альтернативой является применение вакцинации с, так называемых, бактериальными призраками.
Бактериалный призрак (Bacterial ghost) представляют собой неживую преимущественно грамотрицательную пустую бактериальную клетку. Они лишены всех цитоплазматических компонентов, однако имеют мембрану с полным набором антигенных белковых структур.
Призрак можно отличить от живой нелизированной клетки при помощи светового микроскопа. Его клетка выглядит слегка удлиненной и прозрачной по сравнению с живой бактерией. Она имеет канал (40-200 нм) в центре или на полюсе, через который вышли внутриклеточные компоненты.
Свойства и производство бактериальных призраков
Бактериальные призраки лишены цитоплазматических органелл и бактериальной ДНК, то есть не являются живой бактерией. Процесс их производства исключает разрушение оболочки. Отсюда, все антигенные детерминанты остаются целыми. Более того, они могут служить средством доставки лекарственных препаратов, специфической ДНК-вакцин и т.д..
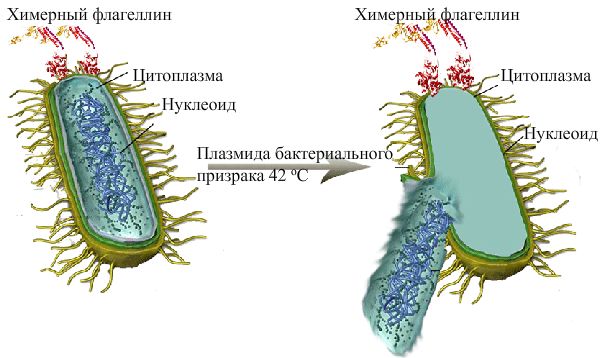
Бактериальный призрак (справа) (илл. 2008.igem.org/Team:Slovenia/Results/Engineered_flagellin_vaccine/Engineered_bacterial_vaccine)
Процесс производства включает экспрессию гена E (бактериофаг phiX174) в клетке мишени (грамотрицательная бактерия). В результате происходит лизис (растворение) оболочки на 40-200 нм в диаметре. За счет осмотического давления между цитоплазмой и окружающей средой через образующуюся пору высвобождается всё содержимое клетки, и остается лишь интактная мембрана.
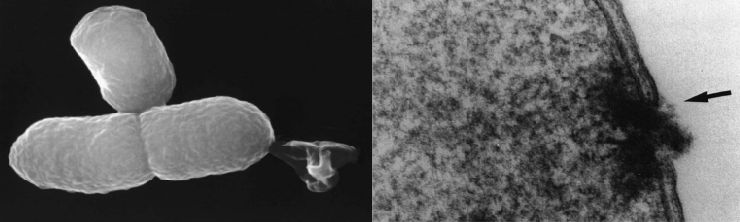
Высокоразрешающая электронная микрофотография грамотрицательной бактерии, подвергшейся действию литического белка. Стрелкой отмечено место растоврения мембраны (илл. www.ncbi.nlm.nih.gov/pmc/articles/PMC3037582/. Timo Langemann et al. The bacterial ghost platform system Production and applications // Bioeng Bugs. 2010 Sep-Oct; 1(5): 326–336.)
Ген E
1. Кодирует 91-aa полипептид, который контактирует с литическими белками и повышает их ферментативную активность [1];
2. Имеет гидрофобную область с N-концом и предполагает, сопряженную с трансляцией, интеграцию в цитоплазматическую мембрану грамотрицательных бактерий [1, 2];
3. Экспрессия и лизис зависит от типа клеточной стенки бактерии (грамотрицательная) и от типа её аутолитической системы [1].
Преимущества использования бактериального призрака
Не является геномодифицированным организмом; может храниться при комнатной температуре; безопасен для животных; может быть произведен в процессе ферментации в промышленных масштабах; потенциально может использоваться и как вакцина (реакция иммунитета на антигенные структуры мембраны)[3] и как средство доставки (лекарственные средства, ДНК-вакцина) [4, 5, 6]; низкая стоимость производства; хорошая распознаваемость и захват антиген-представляющими клетками; бактериального призрака выступает микробиореактором для ферментативных реакций [1].
Практика использования
Введение (орально, ванны, иммунизация) бактериального призрака из Edwardsiella tarda Азиатскому паралихту (Paralichthys olivaceus)
или тиляпии (Oreochromis mosambicus) является эффективной мерой в предотвращении и защите рыб от эдвардсиеллеза [8, 9]. При проведении оральной иммунизации карпа (Carassius auratus gibelio) с использованием бактериального призрака Aeromonas hydrophila также были получены положительные результаты. У карпов активизировалось выделение слизи и системные иммунные ответы на действие возбудителя заболевания [10]
Так как вакцина включает стабильные компоненты клеточной стенки, наилучшим способом введения в условиях аквакультуры признан оральный [9, 12].
——
Литература:
1. Langemann T, Verena Juliana Koller, Abbas Muhammad, Pavol Kudela, Ulrike Beate Mayr and Werner Lubitz. The bacterial ghost platform system: Production and applications. Bioengineered Bugs September/October 2010; 1:5, 326-336.
2. Witte A, Lubitz W. Biochemical characterization of phiX174-protein-E-mediated lysis of Escherichia coli. Eur J Biochem 1989; 180:393-8.
3. Riedmann EM, Kyd JM, Cripps AW, Lubitz W. Bacterial ghosts as adjuvant particles. Expert Rev Vaccines 2007; 6:241-53.
4. Paukner S, Kohl G, Lubitz W. Bacterial ghosts as novel advanced drug delivery systems: antiproliferative activ ity of loaded doxorubicin in human Caco-2 cells. J Control Release 2004; 94:63-74.
5. Ebensen T, Susanne Paukner, Claudia Link, Pavol Kudela, Carola de Domenico, Werner Lubitz, and Carlos A. Guzma«n. Bacterial Ghosts Are an Efficient Delivery System for DNA Vaccines. J Immunol 2004;172;6858-6865.
6. Mayr UB, Petra Walcher, Chakameh Azimpour, Eva Riedmann, Christoph Haller, Werner Lubitz. Bacterial ghosts as antigen delivery vehicles. Advanced Drug Delivery Reviews 2005; 57; 1381Р 1391.
7. Szostak MP. Andreas Hensel, Francis O. Eko, Reinhard Klein, Tatjana Auer, Horst Mader, Alexander Haslberger, Sebastian Bunka, Gerhard Wanner, Werner Lubitz. Bacterial ghosts: non-living candidate vaccines. Journal of Biotechnology 1996; 44; 161- 170.
8. Se Ryaun Kwon, Yoon Kwon Nam, Sung Koo Kim, Ki Hong Kim. Protection of tilapia (oreochromis mosambicus) from edwardsiellosis by vaccination with Edwardsiella tarda ghosts. Fish. Shellfish. Immunol.2006; 20: 621-626.
9. Se Ryaun Kwon, Eun Hye Lee, Yoon Kwon Nam, Sung Koo Kim, Ki Hong Kim. Efficacy of oral immunization with Edwardsiella tarda ghost against edwardsiellosis in olive flounder (Paralichthys olivaceus). Aquaculture. 2007; 269: 84-88.
10. Tu F.P., Chu W.H., Zhuang X.Y. and Lu C.P. Effect of oral immunization with Aeromonas hydrophilla ghosts on protection aganist experimental fish infection. Letters in Applied Microbiology. 2010; 50: 13-17.
Se Ryun Kwon, Yue Jai Kang, Dong Jin Lee, Eun Hye Lee, Yoon Kwon Nam, Sung Koo Kim, Ki Hong Kim. Generation of Vibrio anguillarum Ghost by Coexpression of PhiX 174 Lysis E gene and Staphylococcal Nuclease A Gene. Mo. Biotechnol. 2009; 42: 154-159.
Ra, Chae-Hun, Yeong-Jin Kim, So-Jin Park, Chang-Wha Jeong, Yoon-Kwon Nam, Ki-Hong Kim, and Sung-Koo Kim. Evaluation of Optimal Culture Conditions for Recombinant Ghost Bacteria Vaccine Production with the Antigen of Streptococcus iniae GAPDH. J. Microbiol. Biotechnol. 2009; 19 (9): 982-986.
B.T. Naveen Kumar, Babin Boppanna. K, Omkar V Byadgi , Mansoor ahmad, Prabhugouda Shiriyappagouder, Pradeep L. doddamani, Kamalesh panda, Adi. B1.. Bacterial ghost: Future vaccine candidate for Aquaculture https://aquafind.com/articles/BacterialghostFuture.php
Похожие статьи:
Убивающая американских сомов бактерия имеет азиатские корни
Бактериальное заболевание жабр
Пробиотики в аквакультивировании