 На 240-ой встрече Американского химического общества (ACS), проходившей летом 2010 года, появилось сообщение о тестировании потенциальной вакцины от ихтиофтириоза. Данное инфекционное заболевание поражает рыбу в промышленных хозяйствах и проявляется в виде «белых точек» на теле.
На 240-ой встрече Американского химического общества (ACS), проходившей летом 2010 года, появилось сообщение о тестировании потенциальной вакцины от ихтиофтириоза. Данное инфекционное заболевание поражает рыбу в промышленных хозяйствах и проявляется в виде «белых точек» на теле.
Согласно докладу Дехаи Сю, кандидата философии, вспышки инфекции, вызываемой реснитчатыми инфузориями Ichthyophthirius multifiliis, приводит к потере 50-100% рыбы. По его словам, болезнь очень распространенна, и почти каждый человек, увлеченный рыбками, сталкивался с ней. Как только паразит заражает рыбку, он начинает развиваться в коже, плавниках и жабрах, и от этого нет эффективного лечения. “Ихтик” приводит к финансовым потерям порядка 50 млн. долларов ежегодно, поэтому предотвращение болезни является одной из важнейших целей. В области промышленного рыбоводства можно отметить широкую распространенность инфузории Ichthyophthirius multifiliis, которая поражает коммерческие промысловые угодья площадью, равной 10-20 футбольным полям. Традиционные средства лечения предусматривают использование формальдегида, потенциально ядовитого вещества. При этом необходимо много литров химиката и несколько циклов обработки. Однако, даже после процедур, велик риск повторного заражения при первом же контакте с паразитом.
Как отметил Сю: «Для проведения вакцинации от “ихтика” требуется гораздо меньше усилий, и не будет никакой угрозы окружающей среде. Кроме того, необходима лишь одна процедура, делающая рыбу невосприимчивой к болезни раз и навсегда». В своей работе по созданию вакцины исследователи обратились к изучению, так называемых. трофонтов, формы развития инфузории, находящейся и активно питающейся в тканях рыбы. Именно из-за трофонтов возникают белые точки на плавниках, жабрах и коже хозяина. Тем не менее, исследования тормозились из-за нехватки данных о механизме развития иммунитета к данному паразитическому агенту. Сю решил заполнить эти пропуски вместе с коллегами, доктором Филиппом Клесиусом и Крейгом Шумейкером, членами Департамента сельского хозяйства и сельскохозяйственных исследований США (ARS) в городе Оберн, штат Алабама.
Их работа помогла оценить влияние вакцины и ее дозировки на формирование иммунитета канального сома. Было показано, что вакцинация теронтами и трофонтами, убитыми с помощью высокочастотных звуковых волн, стимулирует производство защитных антител. Авторы работы уверены, что вакцина против ихтиофтириоза помогает вырабатываться защитному иммунитету и может стать уникальным решением проблемы, полностью защищая от заболевания. Значимость этой вакцины очевидна, так как она предотвращает болезнь, сводит к минимуму потерю драгоценной рыбы и увеличивает доходы промышленности.
Сю отметил, что проводимых исследований пока довольно мало и они ограничиваются масштабами лаборатории, поэтому требуется решить еще множество проблем до появления вакцины на рынке. В частности, необходимо наладить производство большого количества антител для вакцины и изготовить вакцину, которую можно будет массово вводить рыбам с помощью общей «ванны» или пищи, а не через индивидуальные инъекции. Подход с использованием лечебных ванн подразумевает помещение рыбы в общий аквариум или отсадник с водой, содержащий вакцину.
Работа проводилась в рамках национальной программы ARS 106-«Аквакультура», направленной на улучшение здоровья и состояния водных животных. Сю и его коллеги надеются, что она привлечет больше внимания к борьбе с болезнью.
——
Дополнение в рамках озвученной темы.
В зависимости от серотипа паразитической инфузории выживаемость зараженных рыбок варьирует. Это связано с возникающим у них иммунитетом. В ответ на антигены клеточной стенки теронтов Ichthyophthirius multifiliis организм хозяина вырабатывает антитела, которые иммобилизируют паразита. В частности, проводились иследования с заражением канального сома Ictalurus punctatus [1]. Особи инфицировались 2 изолятами паразитической ресничной инфузории Ichthyophthirius multifiliis, которые отличались вирулентностью. Изоляты, NY1 и G5, Серотипы A и D, соответственно, выделяли различные поверхностные иммобилизационные антигены.
Серотип — группа микроорганизмов одного вида, объединяемые общей антигенной структурой. Серотип не является таксономической категорией и служит для систематизации патогенных и условно-патогенных микроорганизмов. Данная классификация строится на основе вирулентности, липополисахаридов (ЛПС), грамотрицательности, присутствия экзотоксинов, генетических особенностей или других факторов, позволяющих различить двух особей одного вида;
Вирулентность — способность данного штамма микроорганизма или вируса заражать организм хозяина;
Штамм — чистая культура вирусов, бактерий, других микроорганизмов или культура клеток, изолированная в определённое время и в определённом месте. Штамм не является таксономической категорией. Низшей таксономической категорией любого живого организма является вид. Штамм — это линия организмов одного вида, выделенная в определённое время и в определённом месте.
Вирулентность изолятов сравнивалась после заражения хвостового плавника, последующего подсчета количества паразитов и анализа выживаемости инфицированной рыбы. Хотя уровень NY1 инфицированных рыбок был ниже, чем зараженных штаммом G5, NY1 инфицированные особи погибали, тогда как среди G5 — 51% выживали. Повышенная вирулентность NY1 очевидно определялась его коротким жизненным циклом, когда появляющиеся теронты вновь поражали рыбу, ещё не успевшую развить защитный иммунный ответ (Рисунок 1). Данный доклад является первым экспериментальным свидетельством того, что между серотипами I. multifiliis имеются различия вирулентности.
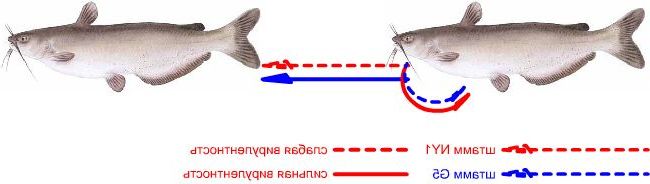
Рисунок 1.
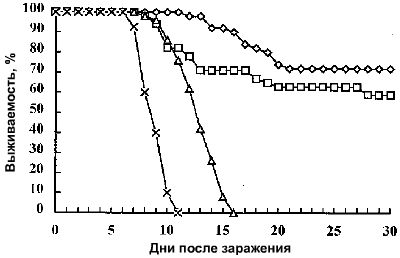
В качестве превентивной меры защиты от паразитирующей инфузории в перспективе может быть использована вакцинация иммобилизационными антигенами (i-антигены). Эффективность очищенных антигенов в качестве подэлемента вакцины проводилось в исследованиях с контрольным заражением паразитами гомологичных или гетерологичных серотипов. В одной из таких работ [2] поверхностные иммобилизационные антигены (i-антигены) выделялись из двух штаммов Ichthyophthirius multifiliis (NY1 и G5), которые представляют различные серотипы i-антигена, известные как A и D, соответственно. При использовании i-антигенов двух серотипов (полученных от NY1 и G5 изолятов) и альбумина бычьей сыворотки в качестве контроля иммунизировались три группы канальных сомов (70 особей в каждой). Белки инъецировались внутрибрюшинно в концентрации 10 мкг/особь вместе с адъювантом Фрейнда на первый день, затем на 15 день следовала вторая инъекция без адъюванта Фрейнда. Рыбки, иммунизированные очищенным i-антигеном, развивали высокий титр сыворотки иммобилизующих антител, в то время как группа, инъецированная альбумином бычьей сыворотки, не развивала иммунитет. Антисыворотка рыб иммобилизировала паразитов гомологичного, но не гетерологичного штамма, и определялась соответствующими i-антигенами при Вестерн-блоттинге в жестких условиях. На 36 сутки, каждая группа делилась на две подгруппы (n=30). Первые подгруппы заражались паразитами G5, а другие NY1. После заражения штаммом G5, иммунизированные G5 i-антигеном рыбки выживали в 70% случаев. После заражения штаммом NY1, иммунизированные NY1 i-антигеном рыбки выживали в 33,3% случаев. Все особи, инъецированные альбумином бычьей сыворотки, погибали.
Развитие специфического иммунитета может достигаться не только инъецированием очищенного i-антигена, но также и бнутрибрюшинным введением живых теронтов. В частности, была выполнена работа по выявлению влияния i-антигена на развитие специфического иммунитета канального сома [3]. Работа схожа с ранее озвученной, однако доступна её электронная версия с полным описанием материалов и методики (cdli.asm.org/cgi/reprint/9/1/176.pdf). Использовался штамм инфузорий Ichthyophthirius multifiliis G5. Рыбки делились на 4 группы: первой вводился i-антиген (последовательность и концентрации инъекций схожи с данными вышеописанной работы), второй группе внутрибрюшинно инъецировали живых теронтов (в первый день внутрибрюшинно 8000 теронтов без адъюванта, на 35 сутки 10000 без адъюванта), третья группа инъецировалась альбумином бычьей сыворотки, а четвертой вводили иммобилизационно-иррелевантный белок I. multifiliis.
Стоит отметить методику размножения и сбора теронтов. В трехлитровую емкость с отфильтрованной через угольный фильтр водой помещались 5 тяжело зараженных рыб с видимыми невооруженным глазом паразитами на всей поверхности тела. Трофонты выходили в воду. Паразитов собирали через 200-ячеистое сито и переводили в 100 мл воду, пропущенную через угольный фильтр. Теронтам давали время развиться (18-20 часов при температуре 22 градуса). Они просеивались через 400-ячеистое сито, собирались центрифугированием при 1000 х г в течение 2 минут и промывались 50 мл воды. Инъецирование производилось 1 мл шприцом с иглой 26 калибра.
После иммунизации начинались инфицирование. С целью определения пороговой концентрации теронтов для заражения, на 28 сутки три группы рыбок (2-7 особей) подвергались инфицированию 5000, 10000 и 15000 теронтами. Наконец, для широкомасштабных испытаний на 89 сутки четвертая группа из оставшихся рыбок подвергалась заражению 15000 теронтами.
Из обзора видно, что в настоящее время проводятся работы с выработкой специфического иммунитета после введения иммобилизационных антигенов, либо теронтов (живых и мертвых). Очевидной проблемой является разработка энтерального метода вакцинации, который видится более удобным для разводчиков и, конечно, менее травматичен для рыбок.
——
1. Swennes AG, Noe JG, Findly RC, Dickerson HW. Differences in virulence between two serotypes of Ichthyophthirius multifiliis.//Dis Aquat Organ. 2006 Apr 6;69(2-3):227-32.
2. Wang X, Clark TG, Noe J, Dickerson HW. Immunisation of channel catfish, Ictalurus punctatus, with Ichthyophthirius multifiliis immobilisation antigens elicits serotype-specific protection. // Fish Shellfish Immunol. 2002 Nov;13(5):337-50.
3. Xuting Wang and Harry W. Dickerson. Surface Immobilization Antigen of the Parasitic Ciliate Ichthyophthirius multifiliis Elicits Protective Immunity in Channel Catfish (Ictalurus punctatus). // CLINICAL AND DIAGNOSTIC LABORATORY IMMUNOLOGY,Jan. 2002, p. 176–181 Vol. 9, No. 1.
4. www.eurekalert.org/pub_releases/2010-08/acs-pov080610.php
Похожие статьи:
Теронты Ichthyophthirius multifiliis находят своего хозяина, имея определенный комплекс поведенческих реакций в ответ на различные химические сигналы
Эндосимбионтная бактерия внутри паразитической ресничной инфузории Ichthyophthirius multifiliis